近日,药学院、细胞应激生物学国家重点实验室、福建省药物新靶点研究重点实验室任长亮教授团队,报道了一类罕见的浓度依赖的自适应型人工离子通道。通道单体在低浓度下能自组装形成氯离子通道,而在高浓度下会进一步组装成为可跨膜传输小分子的纳米孔。同时,通道分子表现出了显著的抗肝癌活性和选择性,有望作为一种潜在的抗癌药物和药物辅助递送系统加以进一步开发。相关成果以“Concentration-Driven Evolution of Adaptive Artificial Ion Channels or Nanopores with Specific Anticancer Activities” 为题,在线发表在《德国应用化学》(Angewandte Chemie-International Edition)杂志。

自然界中,神经酰胺是真核细胞膜中普遍存在的一类天然鞘脂,具有独特的自组装能力,能够形成浓度依赖的自适应型蛋白质传输通道。然而,在人工跨膜通道研究领域,具有类似自适应性特征的例子却极为罕见。该团队采用离域亲脂性阳离子TPP基团作为阴离子识别基团,使其通过聚乙二醇侧链与胆酸相连构建一类自适应型人工通道。低浓度下,两个Pn-TPP分子在膜中通过OH•••Cl−氢键和TPP+•••Cl−静电作用组装形成Cl−介导的反平行排列的二聚体氯离子通道;而在浓度升高时,二聚体之间能通过聚乙二醇侧链间的偶极——偶极相互作用进一步自组装形成纳米孔。
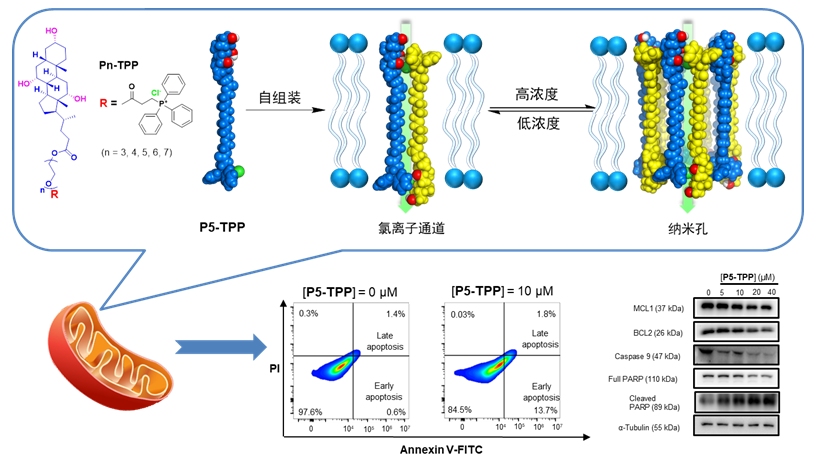
不仅如此,TPP还赋予了通道线粒体靶向性,利用癌细胞线粒体膜电势显著高于正常细胞这一特征,使通道能选择性地破坏癌细胞线粒体的跨膜电势,导致细胞色素c的释放,从而通过激活Caspase 9信号通路引发癌细胞凋亡。通道的抗癌活性与其纳米孔的形成效率相关,活性最高的纳米孔的抗肝癌活性与阿霉素相当,然而其对正常细胞的选择性指数却为阿霉素的16.8倍。
药学院2021级硕士生陈芷青为论文第一作者,任长亮教授为论文通讯作者。该项研究得到了国家自然科学基金(22271240),深圳市科技创新委员会(JCYJ20210324123411030、JCYJ20220530143206013)和厦门大学南强青年拔尖人才计划的支持。该项研究的计算部分得到了新加坡南洋理工大学Mu Yuguang教授团队的大力支持。
论文链接:
https://onlinelibrary.wiley.com/doi/10.1002/anie.202318811

