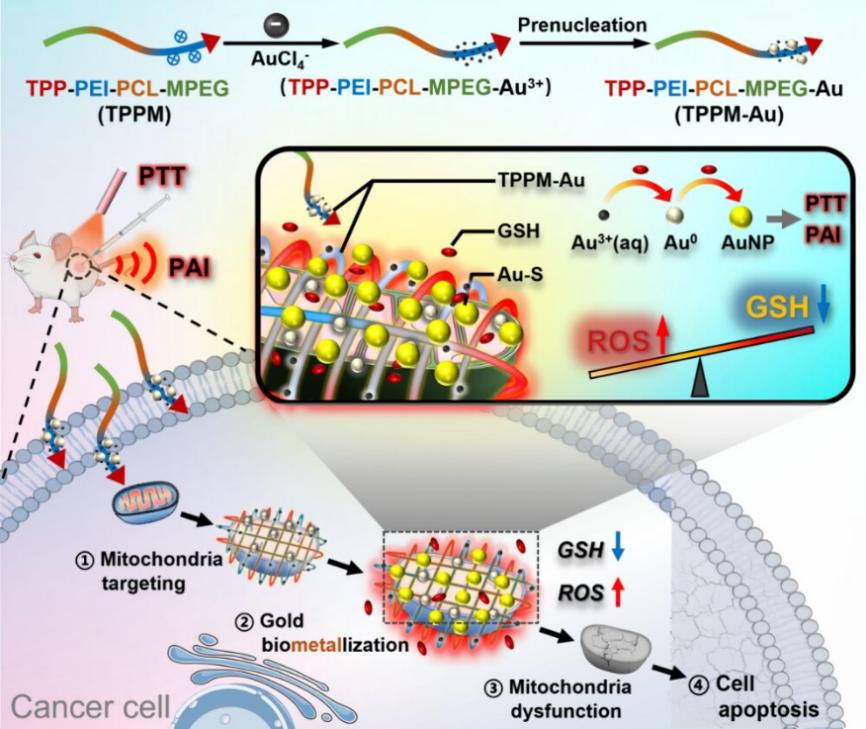
近年来,基于线粒体靶向的癌症治疗策略受到了广泛关注。近日,霍帅东教授、吴云龙教授团队与李子彪研究员合作在ACS Nano期刊发表了题为“Mitochondria-Targeted Gold Biometallization for Photoacoustically Visualized Photothermal Cancer Therapy”的研究论文,报道了一种靶向线粒体的新型生物金属化作用,可用于光声成像引导的光热肿瘤治疗。

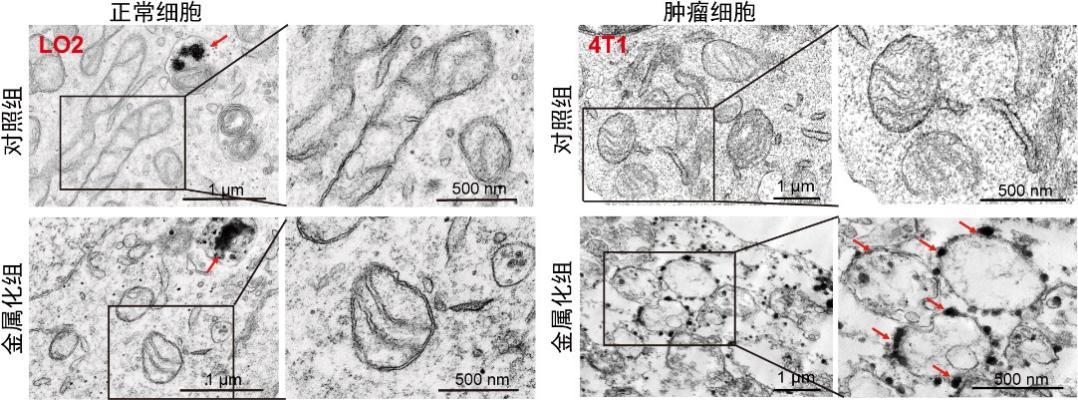
受生物矿化过程启发,研究人员设计了一种含有多个功能嵌段的TPP-PEI-PCL-MPEG(TPPM)共聚物,可以通过静电和鳌合作用高效负载Au3+并将其靶向递送到癌细胞线粒体。在癌细胞内高水平GSH的作用下,Au3+可被快速还原生成金种(Au0)并长大形成金纳米颗粒(GNPs),最终在线粒体部位实现生物金属化过程。同时,Au0将进一步消耗GSH并形成Au-S,显著降低胞内GSH水平,放大线粒体的氧化应激,从而激活线粒体凋亡通路并诱导癌细胞凋亡。重要的是,通过生物金属化生成的GNPs不仅具备优异的光热性能和光声成像特性,还表现出比传统合成GNPs更加优异的肿瘤穿透能力,并可以在成像引导下反馈实时金属化过程,实现精准的光热消融肿瘤治疗。该研究为基于细胞器靶向的生物金属化技术在癌症治疗中的应用提供了新视角,并为开发用于细胞功能干预的诊疗一体化生物金属化或生物矿化系统提供了参考。
近年来,霍帅东教授团队及合作者在细胞器靶向治疗相关领域开展了系列研究:报道了一种能够靶向并破坏癌细胞线粒体铁死亡防御系统的纳米前药,加速癌细胞铁死亡(ACS Nano, 2024, 18, 11, 7945-7958);构建了一种加速肿瘤细胞凋亡的线粒体氧化应激放大器用于癌症治疗(Nature Nanotechnology, 2019, 14, 379-387);系统综述并展望了基于线粒体靶向的多种肿瘤治疗策略(Nanoscale, 2021, 13, 7108-7118);提出了利用超小纳米载体作为核酸载体实现细胞核靶向和基因调控新策略(ACS Nano, 2014, 8, 5852-5862);实现了近红外光调控的细胞核靶向和基因治疗(Science Advances, 2019, 5 (10), eaaw6264)等。
厦门大学药学院、细胞应激生物学国家重点实验室、福建省药物新靶点研究重点实验室霍帅东教授、吴云龙教授以及新加坡科技研究局(A*STAR)李子彪研究员为论文的共同通讯作者,厦门大学药学院2021级博士生罗征为论文的第一作者。该研究得到了国家重点研发计划、国家自然科学基金、福建省自然科学基金以及厦门大学南强青年拔尖人才项目等基金支持。
原文链接:https://pubs.acs.org/doi/epdf/10.1021/acsnano.4c08567?ref=article_openPDF