近日,我院刘超副教授团队、公共卫生学院刘刚教授团队与合作者提出一种可以消除多房棘球绦虫的创新疫苗策略。相关研究成果以“A Bioengineered Nanovesicle Vaccine Boosts T-B cell Interaction for Immunotherapy of Echinococcus multilocularis”为题发表于国际知名学术期刊Angewandte Chemie International Edition。该研究通过在细胞膜表面展示多房棘球绦虫优势抗原表位,构建了一种多房棘球蚴病特异性的工程化囊泡疫苗,该疫苗可高效激活树突状细胞,并诱导特异性T/B细胞互馈回路,抑制多房棘球蚴的感染及生长。

多房棘球蚴病又称包虫病,是由多房棘球绦虫引起的人畜共患疾病。我国是全球多房棘球蚴病流行最严重的国家之一。多房棘球蚴病因其肿瘤样生长和转移能力而被称为“虫癌”。临床数据表明,未经治疗或治疗不充分的多房棘球蚴患者在10-15年内的死亡率为90%左右。针对该疾病的常规治疗策略是切除寄生虫肿块,并辅以药物治疗。然而,大多数患者由于病灶呈多灶性且在肝脏内呈弥漫性分布,因此只有30%患者可以手术切除。对于无法手术的患者,即使长期给予大剂量化学药物,仍无法有效阻止病灶的进一步生长和扩散。因此,迫切需要一种新的治疗方法来提高治疗效果。
免疫治疗是一种通过激活或增强患者的免疫系统来对抗疾病的治疗方法,虽然EmEMY162、EmLAP 等优势表位构建的重组蛋白亚单位疫苗可降低小鼠腹腔感染后的寄生虫载量,但是大肠杆菌无法提供蛋白糖基化等翻译后修饰,且单一重组蛋白或表位通常难以诱发足够的免疫应答。因此,目前传统疫苗策略难以实现对该疾病的有效预防及治疗。
该研究基于刘超副教授团队开发的功能化细胞膜囊泡疫苗平台(Nat Nanotechnol 2022,Adv Mater 2019, et al.),在Vero细胞膜表面展示了多个与多房棘球蚴粘附、生长、组织入侵、繁殖相关的T细胞和B细胞优势抗原表位。进一步采用纳米技术获得的细胞膜囊泡因尺寸可控,及基于仿生学赋予的良好生物活性与免疫反应性,可实现对T/B细胞的高效活化。特别是能同时展示T细胞和B细胞表位的囊泡疫苗可诱导抗原特异性T/B细胞形成相互激活的回路,进一步增强免疫效果。该疫苗通过诱导体液免疫和细胞免疫的相互促进,实现对多房棘球蚴病进展的有效控制。
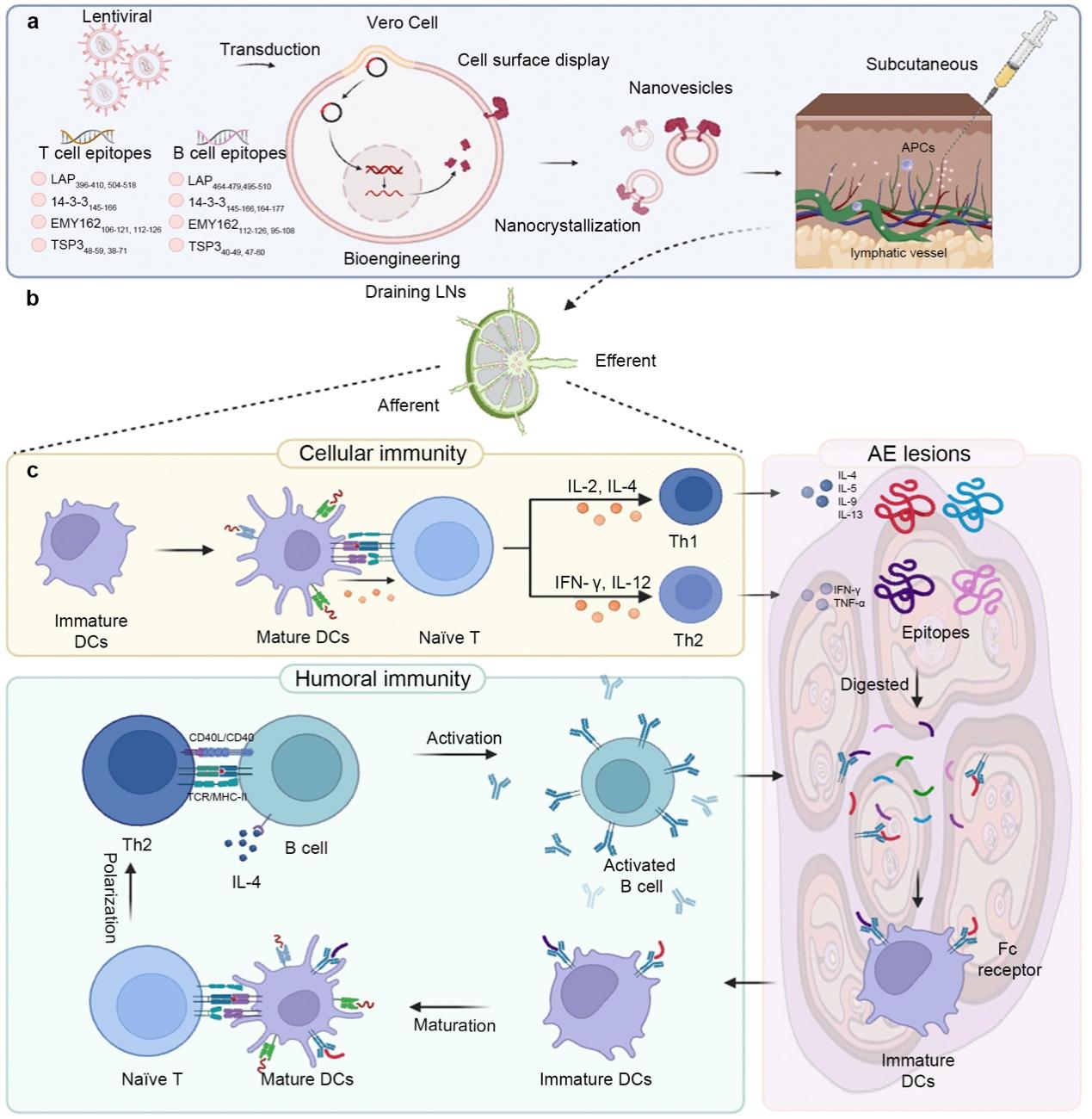
包虫疫苗构建新策略及免疫应答机制示意图
厦门大学药学院刘超副教授、公共卫生学院刘刚教授、生命科学学院程喆副教授及青海大学汤锋教授为该论文共同通讯作者。该研究工作得到国家自然科学基金、厦门大学“南强青年拔尖人才” 等项目的资助。
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202319489

