近日,药学院、细胞应激生物学国家重点实验室、福建省药物新靶点研究重点实验室任长亮教授团队,报道了首个依靠非共价键自身钉合的刺激响应型人工H+/Cl-通道,该人工通道可在442 nm可见光照射下被激活从而实现H+/Cl-的同向跨膜传输。同时,激活后的通道表现出出色的抗结直肠癌活性和选择性,有望作为一种潜在的抗癌药物加以进一步开发。相关成果以“Non-Covalently Stapled H+/Cl- Ion Channels Activatable by Visible Light for Targeted Anticancer Therapy”为题,在线发表在《德国应用化学》(Angewandte Chemie-International Edition)杂志,并被编辑团队遴选为VIP(Very Important Paper)论文。

相比于正常细胞,癌细胞内外有着特殊的质子和氯离子浓度梯度差。利用这一特征,如果能构建可以高活性跨膜传输H+/Cl-的人工离子通道,将有望快速破坏癌细胞的胞内生理平衡从而杀死癌细胞,这一策略为特异性抗癌药物的研发提供了一个新的思路。该团队首次采用非共价键钉合的方式构建了一类高活性的H+/Cl-通道。在自组装过程中,同一分子基于氢键作用产生了两种截然不同的构型,其中三分之二的分子通过π-π堆积和范德华力自组装形成一维的堆积结构,另外三分之一分子充当“分子订书钉”的功能,将自组装的一维结构进行稳定,从而实现了H+和Cl-的高活性跨膜传输。值得指出的是,在自然进化中,大自然能巧妙地利用共价键来钉合维持一维生物分子的结构完整性和稳定性。例如:在DNA的骨架中的磷酸基团通过共价键钉合了相邻核苷酸的糖基团,从而形成稳定的一维双螺旋结构。类似地,肽链的一维α-螺旋结构也常利用两个半胱氨酸残基二硫键的共价钉合来稳定。在人工离子通道领域,通过共价键钉合来稳定已组装的一维通道结构也被广泛地应用。然而,以非共价键来钉合稳定自身通道的例子还是首次报道。
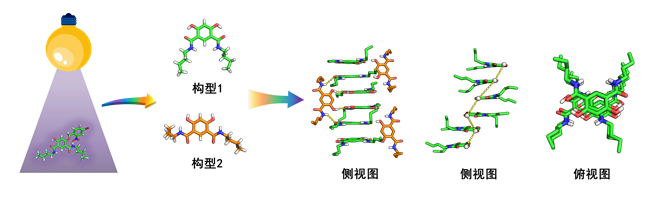
此外,这类高稳定性的H+/Cl-通道能够快速破坏癌细胞膜内的离子稳态,通过破坏线粒体的跨膜电位和溶酶体内的酸性环境来干扰线粒体和溶酶体的功能,从而引发结直肠癌细胞(HCT116)的凋亡。为提高通道对癌细胞的特异性,该项研究还对通道赋予了刺激响应特性,仅在442 nm可见光照射下才能将通道激活,从而选择性地杀死癌细胞,减低其对正常细胞的毒副作用。
厦门大学为该论文的第一完成单位,2021级硕士生仲启硕与2020级博士生曹银为论文的共同第一作者,任长亮为论文的通讯作者。该项研究得到了国家自然科学基金(22001221、22271240)、深圳市科技创新委员会(JCYJ20210324123411030、JCYJ20220530143206013)和厦门大学南强青年拔尖人才计划的资助。该研究还得到了厦门大学药学院吴振、严小胜和曾志平团队以及河南师范大学辛鹏洋团队的大力支持。
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202314666

