近日,药学院、细胞应激生物学国家重点实验室、福建省药物新靶点研究重点实验室任长亮教授团队与福州大学化学学院曾华强教授团队合作,报道了首个具有跨膜传输活性的胆固醇促进稳定型人工纳米孔。该人工纳米孔的离子跨膜传输能力与膜上胆固醇含量呈显著的正相关性,同时还可通过调节孔道中心侧链长度来影响其孔径大小及抗癌活性,其中纳米孔Ch-C1表现出出色的抗肝癌活性和选择性,有望开发成为一种新型的抗癌药物。相关成果以“Cholesterol-stabilized membrane-active nanopores with anticancer activities” 为题,在线发表于《自然∙通讯》(Nature Communications)杂志。
胆固醇是真核细胞膜结构的重要成分,但通常不存在于细菌细胞膜中,细菌利用这种差异化,进化出了胆固醇依赖型溶细胞素 (Cholesterol-Dependent Cytolysin, CDC)。CDC是一类细菌蛋白毒素家族,仅在胆固醇存在时才会在膜上组装形成孔洞结构,从而特异性靶向和伤害真核细胞,巧妙的避免了毒素对细菌自身造成的损伤。除此之外,一部分通道蛋白也表现出类似的活性受胆固醇上调的性质,包括:烟碱型乙酰胆碱受体 、上皮钠离子通道、瞬时受体电位通道和阿尔茨海默 β-淀粉样肽等。通过胆固醇来上调离子跨膜传输活性的例子,尽管在自然界中存在众多,但在人工跨膜传输领域尚未被开发。
为解答上述科学问题,该团队受两性霉素 B (AmB) 可在麦角甾醇协助下形成“桶-板”跨膜通道的启发,基于胆酸衍生物设计合成了一系列刚性的线性跨膜分子,并证实该线性分子能够在胆固醇存在时组装成类似桶状结构的纳米孔。跨膜传输活性测试证明这类孔道的跨膜传输能力受膜上胆固醇含量的显著调节,并在胆固醇为磷脂分子含量50%时效果最优;通过进一步的平面脂双层膜片钳实验确定了纳米孔的孔径大小,并发现孔径尺寸随着中心侧链延长而递减。
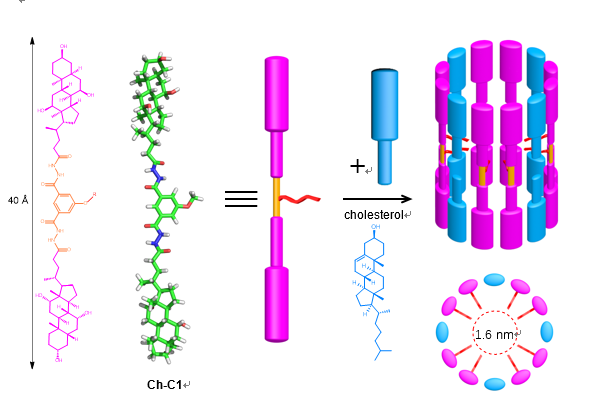
由于细胞膜内外生理平衡的破坏容易导致细胞死亡,该工作还进一步探究了该类人工纳米孔的抗癌活性:细胞增殖实验发现该类分子对肝癌细胞HepG2具有较好抑制作用,其中Ch-C1的活性最佳,IC50值仅为3.8 μM。令人惊喜的是Ch-C1还表现出出色的选择性,对正常肝、肾细胞的选择性指数高达12.5与130。受Ch-C1突出的抗肝癌活性的鼓舞,团队初步探索了Ch-C1的抗肿瘤机制,发现Ch-C1可以通过破坏细胞膜的通透性,从而激活Caspase-9信号通路,诱导肝癌细胞凋亡。这一重要发现为开发新型抗癌药物提供了一个全新的思路。
厦门大学为该论文的第一署名单位,药学院任长亮教授及福州大学曾华强教授为论文共同通讯作者。该项研究得到了国家自然科学基金(22001221、81971724和U1903119),深圳市科技创新委员会(JCYJ20210324123411030、2021Szuvp067)和厦门大学校长基金(20720210101)的资助。该研究还得到了药学院吴振教授、吴彩胜副教授和吴云龙教授团队的大力支持。
论文链接: https://www.nature.com/articles/s41467-022-33639-5

