近日,细胞应激生物学国家重点实验室、福建省药物新靶点研究重点实验室、药学院刘文教授团队研究发现小分子抑制剂iJMJD6能够特异性靶向加氧酶JMJD6,抑制JMJD6的精氨酸去甲基化酶活性,从而有效抑制癌基因的表达以及乳腺癌、肝癌、宫颈癌、脑胶质瘤和结直肠癌等多种肿瘤的生长,为相关癌症治疗提供一种潜在的、新颖的治疗方式。相关成果以“ A specific JMJD6 inhibitor potently suppresses multiple types of cancers both in vitro and in vivo“ 为题在线发表于PNAS杂志。
含JmjC结构域的JMJD6蛋白是金属离子和α-酮戊二酸依赖的加氧酶家族中的一员。JMJD6在多种癌症中高表达,并且其高表达往往预示预后差。JMJD6能够促进多种癌症的发生发展,并且这种促癌功能和其酶活性紧密相关。因此,开发高效且特异靶向JMJD6酶活性的抑制剂对癌症的治疗具有广阔的前景。
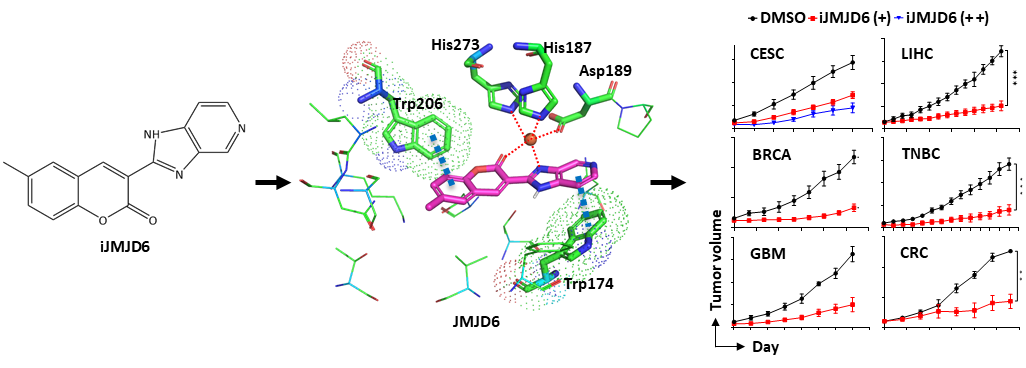
刘文教授团队通过大规模筛选,发现了JMJD6的小分子抑制剂iJMJD6。iJMJD6能够特异的结合JMJD6酶活性中心的-酮戊二酸和底物结合位点,从而在体外以及细胞内特异且有效地抑制JMJD6的酶活性。iJMJD6对JMJD6高表达的肿瘤细胞的毒性较大,而对JMJD6低表达的正常细胞毒性较弱。iJMJD6能够特异性靶向JMJD6从而抑制多种肿瘤细胞的增殖、迁移和侵袭等恶性表型。从机制上来说,iJMJD6能够抑制Myc和CCND1等癌基因的表达。iJMJD6具有较为理想的物理化学参数和药物动力学特性,能够有效地抑制多种癌症细胞和患者来源的移植瘤的生长。另外,iJMJD6的体内有效剂量具有很好的安全性。最后,iJMJD6与BET蛋白抑制剂JQ1或雌激素受体拮抗剂ICI联用时,能够更好的抑制肿瘤的生长。
刘文教授团队长期专注JMJD6蛋白的研究,取得了一系列高水平研究成果:揭示了JMJD6和其相互作用的BRD4蛋白通过与基因组增强子结合依赖其去甲基化酶活性远程调控P-TEFb蛋白复合体的活性,从而调控邻近编码基因转录延伸的转录调控新颖模式(Cell. 2013 Dec 19;155(7):1581-95)。进一步还发现了JMJD6的另一个功能:直接和RNA发生相互作用,作为一个RNA结合蛋白在基因可变剪接中发挥至关重要的作用(Nucleic Acids Res.2017 Apr 7;45(6):3503-3518)。最近,团队发现JMJD6在ERα阳性乳腺癌的发生发展中至关重要,揭示了JMJD6是调控雌激素受体介导的基因转录激活、癌细胞的生长和肿瘤形成的重要因子,并且这样的功能和其酶活性密切相关(Mol Cell. 2018 Apr 19;70(2):340-357.e8)。基于此,团队进一步针对JMJD6的酶活性中心成药性口袋进行了大规模的活性小分子筛选的研究工作,获得了多个和JMJD6结合力强、酶活性抑制率高、特异性好和癌症细胞生长抑制率高的活性小分子(ACS Med. Chem. Lett. 2019 Nov 19, 10, 1609−1613)。其中的两个活性小分子及其相关应用获得了两项专利授权(专利号:ZL201711476073.8;ZL202010973010.9)。
刘文教授团队博士后肖荣权为本论文的第一作者,刘文教授为通讯作者。该研究得到了国家重点研发计划、国家自然科学基金、福建省自然科学基金、厦门大学校长基金和中国博士后科学基金的资助。该研究还得到了药学院吴彩胜、高祥和严小胜等各位老师的大力支持。
原文链接:https://www.pnas.org/doi/full/10.1073/pnas.2200753119
(图文:药学院)

