近日,厦门大学药学院高祥副教授团队联合浙江大学陆华松研究员团队及加州大学伯克利分校周强教授团队,在Nature子刊《自然∙细胞生物学》(Nature Cell Biology)杂志在线发表了题为 “Poly(ADP-ribosylation) of P-TEFb by PARP1 disrupts phase separation to inhibit global transcription upon DNA damage” 的研究论文,揭示了ADP核糖基化修饰调控基因转录的新机制。研究发现DNA损伤后PARP1介导的多聚腺苷二磷酸核糖基化修饰(Poly-ADP-ribosylation, PARylation)可以破坏P-TEFb亚基CycT1相分离(Phase Separation),进而抑制细胞整体转录。
细胞发生DNA损伤时会迅速下调转录以阻止错误信息的传递,从而维持基因组的稳定性,但RNA 聚合酶Pol II转录延伸的有效暂停机制尚不清楚。该研究利用组学质谱技术从蛋白质翻译后修饰的角度系统鉴定了DNA损伤过程中P-TEFb的ADP核糖基化修饰,进而调控Pol II的CTD区域“YSPTSPS”七肽重复序列的磷酸化修饰程度,揭示了DNA损伤后基因转录沉默的新机制。值得注意的是,蛋白质ADP核糖基化修饰与磷酸化修饰的结构中均包含磷元素,凸显了磷元素作为生命过程基本元素的关键作用。
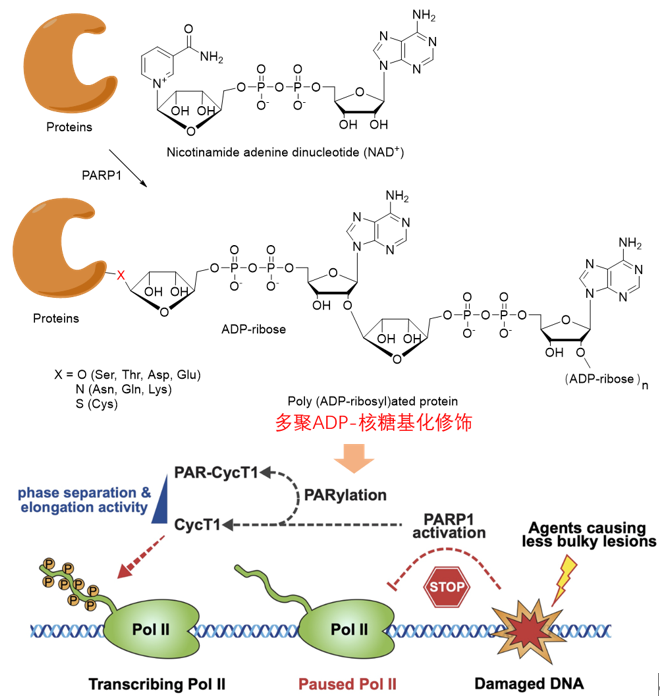
图1. CycT1的多聚ADP-核糖基化修饰调控DNA损伤后的转录沉默机制示意图
蛋白的ADP核糖基化修饰发挥着多种重要的生物功能,如DNA损伤与修复、细胞应激和免疫反应、衰老过程、肿瘤代谢等。然而,蛋白ADP核糖基化修饰的高度异质性、动态变化、含量低以及修饰本身的不稳定性等因素,使ADP核糖基化修饰的分析极具挑战。该研究依托厦门大学生物医学仪器共享平台完备的组学质谱设备,对样品富集制备方法及质谱测试参数进行了系统优化,比较了多种肽段测序裂解模式的差异,如HCD、CID及ETD(电子迁移裂解)等,建立了一套能够无偏差鉴定ADP核糖基化修饰位点的工作流程,主要包括修饰肽段的富集、PARG修剪、二级质谱ETD裂解等关键步骤。高可信度鉴定CycT1上的12个ADP核糖基化修饰位点,特别是发现较为少见的组氨酸残基ADP核糖基化的直接修饰。上述质谱分析流程将为不同生命过程中ADP核糖基化修饰的相关研究提供了重要参考。

图2. 蛋白ADP核糖基化修饰的质谱分析策略
厦门大学药学院培养的博士生刘荣雕为论文共同第一作者,高祥副教授、陆华松研究员及周强教授为论文共同通讯作者。该工作得到了厦门南方海洋研究中心及国家自然科学基金等项目的经费资助。
论文链接:https://www.nature.com/articles/s41556-022-00872-5
(图文:药学院)

