近日,药学院刘文教授课题组和汕头大学医学院李恩民教授、许丽艳研究员课题组在Nature Communications合作发表研究论文。该研究从多维组学层面全面揭示了食管癌中失调蛋白、磷酸化修饰位点及相关信号通路,发现了食管癌中具有显著生存差异的两个蛋白质组亚型,预测了针对高风险亚型的药物,并验证了药物的有效性,为指导食管癌患者的治疗决策和药物开发提供了新的思路。
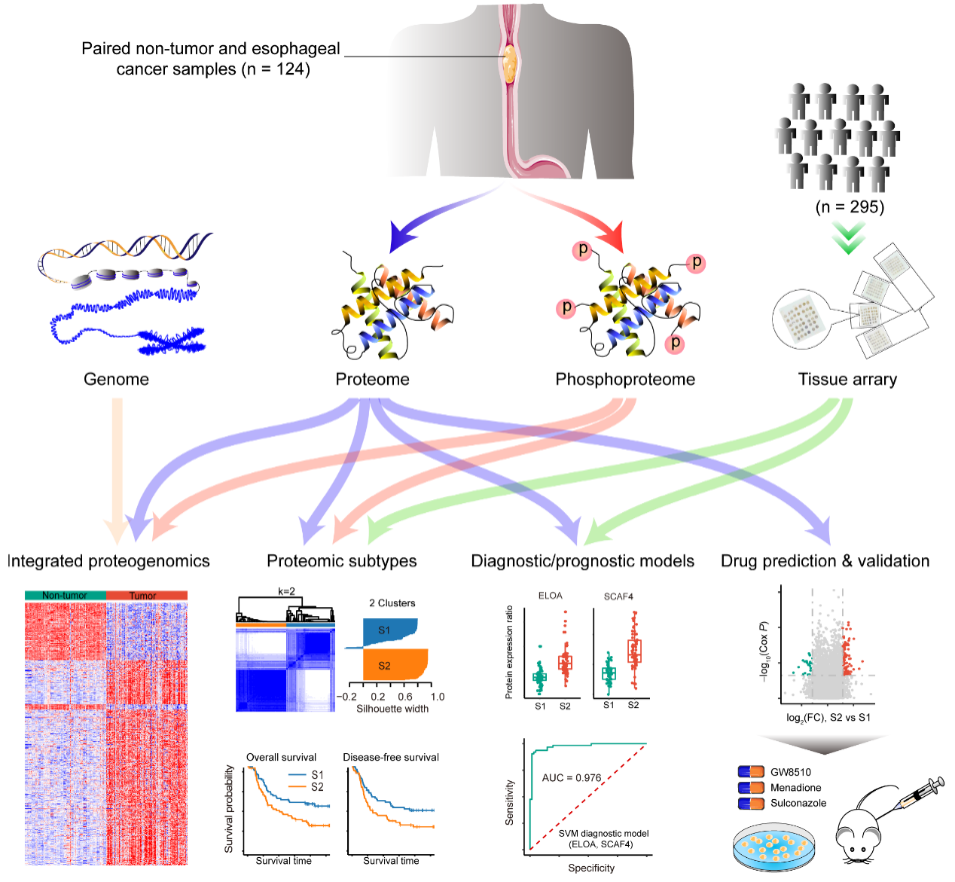
食管癌是我国高发的恶性肿瘤。近十多年来,基因组、转录组层面的研究促进了食管癌分子机制的解析,但与其它癌症类型相比,食管癌基于基因组和转录组数据的分子分型、预后标记物及靶向治疗靶点仍颇为局限。蛋白组学分析能更深层次揭示基因组和转录组无法解密的肿瘤生物学密码,为癌症临床治疗研究开辟新方向。
该研究通过高分辨率质谱技术,针对食管癌及癌旁组织(124对)进行了蛋白质组学和磷酸化修饰组学分析。蛋白组学分析发现,食管癌中大量蛋白差异表达,其中包括cell cycle, DNA repair, immune response和EMT相关的蛋白的显著上调,以及metabolism和estrogen response-related pathways相关蛋白的下调。同时,磷酸化修饰组学分析揭示一些和cell cycle, EMT, estrogen response-related pathways相关的蛋白,尤其是spliceosome相关蛋白的的磷酸化高度富集。PTM-SEA分析发现,CDK1、CDK2、CDC7、CHEK2和MELK等kinase-substrate signatures显著上调,为食管癌的靶向治疗提供了候选靶点。此外,与食管癌已知的基因组突变数据整合分析,补充了基因组、转录组研究的不足,有助于从多维度深刻理解食管癌致病机制。
尤为重要的是,该研究通过无监督聚类分析,发现了食管癌中存在具有显著生存差异的两个蛋白组亚型S1和S2,其中S2亚型的特征是剪接体和核糖体蛋白上调,更具侵袭性。该研究进一步指出ELOA和SCAF4两个蛋白的表达水平能区分S1和S2亚型,并构建了两个亚型的诊断和预后模型。针对S1和S2的亚型差异蛋白分析,研究者预测了治疗S2亚型患者的三种潜在的药物Menadione,GW8510和Sulconazole,并通过系列的生物学功能实验,验证了此三种候选药物对食管癌细胞的显著抑制效果。最后,动物实验进一步验证了药物效能。这些研究结果拓展和加深了对食管癌分子致病机制的解析,为推进食管癌的分层治疗和药物开发开辟了新方向。
该研究工作得到了科技部国家重点研发计划、国家自然科学基金-广东省联合基金重点项目以及国家自然科学基金面上项目等项目支持。
论文链接:https://doi.org/10.1038/s41467-021-25202-5

