献礼百年:药学院刘文教授团队发文Nature 子刊揭示精氨酸甲基化修饰网络及有关促癌机制
百年校庆来临之际,药学院刘文教授团队在Nature子刊Nature Communications杂志上发表论文,揭示了精氨酸甲基转移酶家族蛋白介导的精氨酸甲基化修饰网络及其协同调控基因剪接和促癌机制。
精氨酸甲基转移酶(protein arginine methyltransferase, PRMT)家族蛋白及其介导的精氨酸甲基化修饰与癌症的发生发展密切相关。PRMT主要有9个成员:PRMT1到9。精氨酸甲基化修饰分为单甲基化、对称性双甲基化和非对称性双甲基化修饰。PRMT家族成员依据其催化的精氨酸甲基化修饰分为I,II,III三型,其中I型包括PRMT1,2,3,4,6和8,能催化单甲基化和非对称双甲基化;II型包括PRMT5和9,能催化单甲基化和对称双甲基化;III型的PRMT7只能催化单甲基化。大量研究报道了I型和II型PRMT的甲基化修饰底物的鉴定,但唯一一个III型PRMT 成员PRMT7的底物及其与I型和II型PRMT的底物的关系仍是未知。
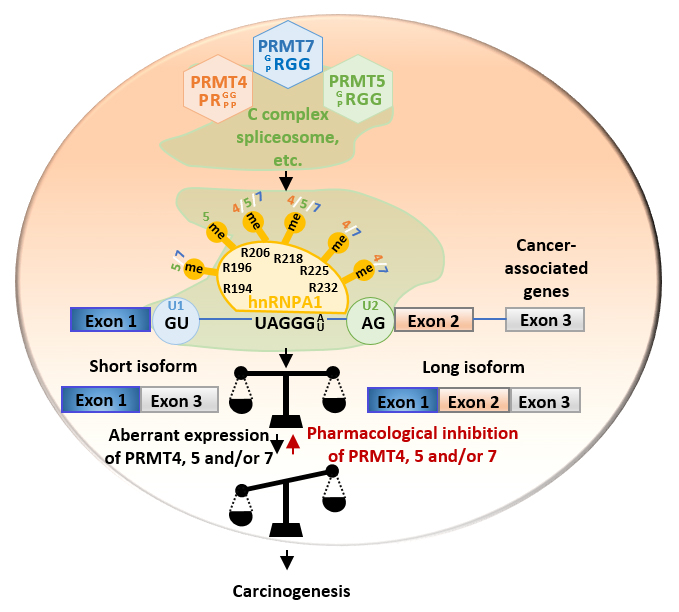
研究团队利用高分辨率质谱系统地鉴定了细胞中PRMT7的精氨酸甲基化底物(甲基组,methylome),并与PRMT4和PRMT5的底物进行了比较分析,首次揭示了I型、II型和 III型PRMT介导的甲基化修饰网络。基于所鉴定到的甲基化底物,研究团队集中研究PRMT4,5和7协同甲基化修饰RNA剪接因子hnRNPA1从而调控癌症相关基因剪接和促癌的功能和分子机制。
首先,研究团队系统鉴定了蛋白质组中PRMT7调控的精氨酸甲基化位点并揭示其介导的甲基化修饰的特征:PRMT7偏向于甲基化富含甘氨酸和精氨酸序列(RGG motif);一个蛋白上经常存在多个PRMT7甲基化位点,且这些位点附近氨基酸磷酸化频率偏高;PRMT7调控的甲基化位点和附近的氨基酸在癌症中的突变频率偏高;PRMT7底物中富集与剪接体和RNA调控相关的蛋白。进一步通过对PRMT4和PRMT5底物的鉴定和比较发现,PRMT4、PRMT5和PRMT7甲基组共享一群与mRNA剪接相关的蛋白。RNA-seq分析发现PRMT4、PRMT5和PRMT7共同调控一群和癌症密切相关的基因可变剪接事件。进一步的机制研究发现,PRMT4、PRMT5和PRMT7能以不同形式共同作用于RNA剪接因子(例如hnRNPA1)并且共同促进其与mRNA前体(pre-mRNA)的结合,从而调控基因可变剪接。
临床上发现PRMT家族成员在癌症中经常共表达并且高表达,但其具体的临床意义不甚清楚。团队研究证实PRMT4、PRMT5和PRMT7在乳腺癌、结直肠癌和前列腺癌临床样品中均呈现高表达,并且PRMTs的高表达和hnRNPA1精氨酸甲基化的富集以及异常的选择性剪接高度相关。在乳腺癌、结直肠癌和前列腺癌细胞中,PRMT4,PRMT5和PRMT7以及它们介导的hnRNPA1甲基化和剪接异构体能有效促进癌细胞生长。最后,团队研究发现特异性靶向PRMT4、PRMT5和PRMT7的活性小分子能有效抑制癌细胞的生长,且三者联合使用具有协同作用,这为相关癌症治疗提供了新的方向和途径。
学院刘文教授为文章的通讯作者,课题组博士生李文娟、何耀辉和硕士生杨晶晶为共同第一作者。该研究工作获得了科技部重点研发计划,国家自然科学基金,福建省卫生教育联合攻关计划,厦门市科技计划项目,厦门市科技重大专项和中央基本科研业务费等多个项目的经费支持。
论文链接:https://www.nature.com/articles/s41467-021-21963-1

