大量研究表明表观遗传调控因子在基因转录调控中可以发挥激活和抑制双重活性,并参与癌症等疾病的发生发展。然而,这种双重活性在特定的细胞环境中是如何协调发挥功能有待探索。近日,药学院刘文教授团队在Advanced Science杂志上发表题为“The Dual Function of KDM5C in Both Gene Transcriptional Activation and Repression Promotes Breast Cancer Cell Growth and Tumorigenesis”的研究论文,报道了蛋白去甲基酶KDM5C能够通过激活和生长密切相关的雌激素受体(ERα)靶基因促进细胞生长,并抑制I型干扰素(IFNs)和干扰素靶基因(ISGs)来逃避免疫检测,从而协同促进雌激素受体阳性乳腺癌发生发展的研究成果。
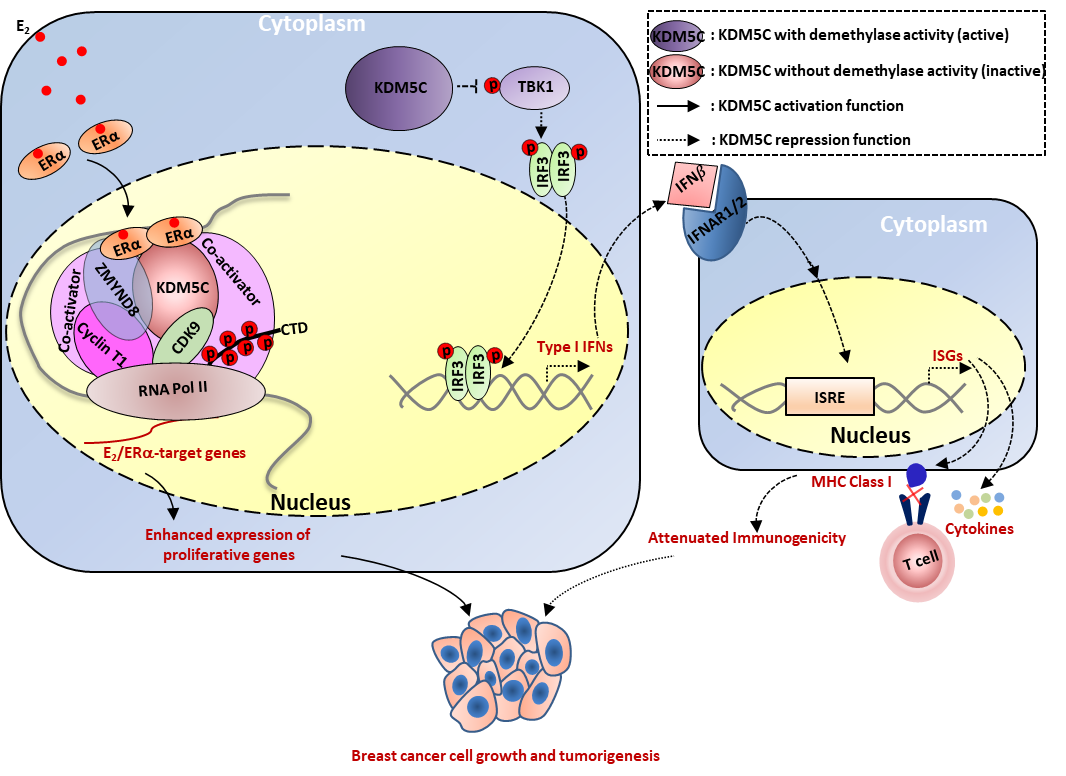
在该研究中,研究团队首先通过对组蛋白去甲基酶家族的系统筛选,并结合临床表达以及临床预后的数据,确定了KDM5C是参与雌激素/雌激素受体介导的靶基因转录激活和乳腺癌细胞生长的候选基因之一。KDM5C被发现分布在细胞核和细胞质内。核内的KDM5C能去甲基化组蛋白H3K4me2/3修饰,一直认为是一个转录共抑制因子,所以探究其如何参与基因转录激活成为一个重要的科学问题。团队利用RNA-seq和ChIP-seq等高通量测序技术并结合生物信息学分析发现在雌激素的刺激下,细胞核内KDM5C被招募到染色质上雌激素受体结合的活性增强子处。在这些增强子处,KDM5C由于其通过酶活性区域与雌激素受体相互作用,其去甲基化酶活性被雌激素受体掩盖。进一步研究发现KDM5C通过招募P-TEFb复合物激活雌激素靶基因,变成一个转录共激活因子。同时,细胞质内的KDM5C被发现通过直接和TBK1相互作用并抑制TBK1磷酸化来抑制I型干扰素和干扰素靶基因,保护细胞免受免疫监视,并且这种功能是依赖于其酶活性的。由此,KDM5C能够通过激活和生长等密切相关的雌激素受体(ERα)靶基因来促进细胞生长,并抑制I型干扰素(IFNs)和干扰素靶基因(ISGs)来逃避免疫监视,从而协同促进雌激素受体阳性乳腺癌发生发展的研究成果。值得一提的是,KDM5C相互作用蛋白ZMYND8参与了KDM5C所调控的基因激活和抑制。最后,研究团队通过对小鼠皮下移植瘤联合使用雌激素受体抑制剂和KDM5家族的酶活性抑制剂,证明了同时抑制雌激素受体信号通路和KDM5活性能有效抑制雌激素受体阳性乳腺癌细胞生长和肿瘤发生。这项研究不仅为乳腺癌提供了一个新的药物靶点和一个潜在的治疗方案,同时也为针对KDM5家族的小分子抑制剂的筛选提供了理论基础。
药学院刘文教授为文章的通讯作者,课题组博士生沈海峰(已毕业)为第一作者。该研究工作获得了国家自然科学基金,福建省卫生教育联合攻关计划,厦门市科技计划项目,厦门市科技重大专项和中央基本科研业务费等多个项目的经费支持。

