张晓坤课题组发现核受体RXRα调控肿瘤细胞有丝分裂新机制及潜在药物
12月15日,厦门大学药学院张晓坤教授课题组在Cell子刊Developmental Cell以封面文章的形式发表重要创新成果,首次阐明了核受体RXR调控肿瘤细胞有丝分裂增殖的新型作用机制,为以核受体RXR为靶点的抗肿瘤药物开发,以及抗有丝分裂的肿瘤治疗策略,提供了全新的研发角度和深具潜在应用价值的线索。运用该机制,针对核受体RXR靶点,已筛选获得无明显毒副作用的潜在抗肿瘤药物分子XS060。这是张晓坤团队继在国际上首次发现核受体Nur77定位到线粒体上调控线粒体功能(Science, 2000;Cell, 2004;Cancer Cell, 2008, 2011;Molecular Cell, 2017)之后,在核受体领域取得的又一个开创性的重大发现。
有丝分裂是细胞分裂增殖的重要方式,对生长发育和遗传起到至关重要的作用,其调控失调与肿瘤的发生发展密切相关。在有丝分裂过程中,调控基因转录的众多核转录因子到哪里去、行使何功能,迄今不清。
张晓坤团队首次揭示了核受体RXR在有丝分裂时通过移位调控细胞的有丝分裂。研究发现,RXR在有丝分裂开始时即从细胞核移位至功能上确保染色体精确分离的微管组织中心(centrosome,中心体),该移位由周期蛋白依赖性激酶Cdk1通过磷酸化RXR的第56位和第70位丝氨酸启动,移位于中心体的磷酸化RXR然后与调控有丝分裂的关键激酶PLK1相互作用,调控中心体功能及有丝分裂进程(示意图如下)。这一新型作用模式的发现,对深度了解细胞增殖和遗传机制有重要的意义,并为研究其他核转录因子调控有丝分裂及细胞生长增殖提供了新的研究方向。
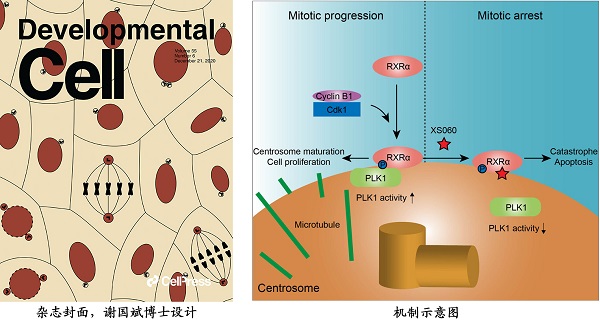
更进一步地,研究团队通过对肿瘤细胞、动物肿瘤组织和临床肿瘤大样本的分析发现,上述Cdk1磷酸化的RXR蛋白在肿瘤细胞中异常高表达,其在肿瘤发生发展中起到了重要的推动作用,同时也是肿瘤细胞脆弱性的表征。发现并鉴别肿瘤细胞有别于正常细胞的特征,是当前开发高效低毒抗肿瘤药物的一个重要突破口,研究团队针对肿瘤细胞异常有丝分裂活动之特性,找到了核受体RXR这一特异靶标,它的发现和机制阐释,无疑为研发抗肿瘤靶向药物开辟了全新的途径。
靶向有丝分裂是国际上肿瘤药物开发的热点。例如广泛应用于肿瘤治疗的紫杉醇,即通过聚合微管蛋白、促进微管稳定、抑制肿瘤细胞的有丝分裂而触发肿瘤细胞凋亡。但紫杉醇存在着严重的副作用。针对调控肿瘤细胞有丝分裂的核受体RXR靶点,张晓坤团队以筛选化合物库的方式,寻找到XS060小分子化合物,可特异性靶向磷酸化的RXR,通过抑制磷酸化的RXR与PLK1的相互作用,导致肿瘤细胞中心体功能异常、纺锤体无法组装和染色体的错误排列,进而显著地把肿瘤细胞阻滞在有丝分裂期,最终肿瘤细胞发生凋亡。令人欣喜的是,XS060对正常细胞没有明显毒副作用,有望成为出色的抗肿瘤药物分子。
论文题为“Centrosomal localization of RXR promotes PLK1 activation and mitotic progression and constitutes a tumor vulnerability”,厦门大学药学院博士谢国斌、周雨琪为共同第一作者,张晓坤教授为通讯作者。藤济生物医药科技有限公司的苏迎博士团队及厦门大学附属中山医院的尹震宇教授团队参与了该研究工作。该工作得到了国家自然科学基金委面上项目,海洋经济创新的区域示范开发项目,福建省科技厅,中央高校基础研究项目和厦门医疗卫生重点项目等的经费支持。
论文链接:https://www.cell.com/developmental-cell/fulltext/S1534-5807(20)30888-1

(厦门大学药学院 洪昀 谢国斌)

