结肠癌调控机制及抗癌研究新进展
——厦大药学院张晓坤课题组发文Nature子刊Nature Communications
2019年4月1日,厦门大学药学院张晓坤教授课题组在Nature子刊Nature Communications (IF=12.353)在线发表研究论文,揭示了tRXRα通过炎症细胞调控炎症信号促进结肠炎相关性结肠癌发生发展的作用机制,以及tRXRα特异靶点小分子K-80003可以结合tRXRα抑制结肠炎相关性结肠癌发展的良好药用结果。
我国每年新发结直肠癌的临床病人约有30多万人,居肿瘤类第三位,其发病率与死亡率均为世界平均水平的2倍以上。张晓坤教授课题组自主研发的靶向抗癌药物分子K-80003已于2016年12月30日获得美国FDA的临床试验许可批件,正式进入新药上市前的临床人体试验阶段,正在晚期结直肠癌患者中开展临床测试。这一发现的原始创新性十分突出,兼具抗癌“新机理”、“新靶点”和“新药物分子结构的发现、阐明和开发”三大创新点于一体,可以说是我国首例从源头开始的抗癌药物自主研发。
张晓坤教授课题组所发现的抗癌药物“新靶点”即tRXRα,它是在肿瘤细胞中产生的核受体RXRα的突变体, 课题组自2010年创新发现这一靶点开始,围绕其促进肿瘤发生发展的作用,及作为药物靶点的可行性等关键问题开展了一系列前沿研究。此次课题组成功构建了tRXRα转基因小鼠,阐述了tRXRα促进肿瘤发生发展的功能及机制,及其作为治疗结肠癌靶点的可行性及特异性。这一研究也进一步阐明了K-80003分子具有特异高效的抑瘤作用。
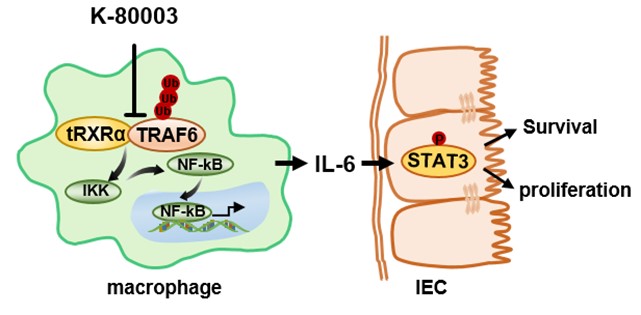
图1:tRXRα与TRAF6相互作用激活NFκB促进肿瘤细胞生长
课题组首先构建tRXRα-flox转基因小鼠,利用Cre-loxp系统获得全身过表达tRXRα小鼠(Tg-tRXRα)和组织特异过表达tRXRα小鼠。致癌剂AOM可以诱导肠上皮细胞DNA突变,促进细胞的增殖,而促炎剂DSS破坏肠细胞粘膜促进炎症的产生。在AOM/DSS联合诱导的肠炎肠癌模型中,Tg-tRXRα小鼠比WT小鼠具有更多的肿瘤个数和肿瘤多样性, 证明tRXRα对肿瘤的发生和发展都有促进作用。
进一步研究发现,tRXRα在肠炎肠癌组织中促进炎症因子IL-6和TNFα的上调、巨噬细胞浸润的增加以及STAT3的激活。利用tRXRα-flox小鼠与lysM-cre小鼠交配获得的炎症细胞特异过表达tRXRα小鼠,验证tRXRα在炎症细胞的促瘤作用。分子机制的研究阐释了tRXRα在炎症细胞中与TRAF6相互作用,促进TRAF6的泛素化、IκBα的降解和NF-κB信号通路的激活。NF-κB信号通路是一个经典的炎症信号,可以调控炎症因子IL-6和TNFα的表达。IL-6的上调可以促进STAT3的激活,从而促进肠肿瘤细胞的增殖。
有意义的是,临床肠癌标本中发现tRXRα在不同结肠癌分期中高表达存在,这提示我们tRXRα可能是治疗结肠癌的一个良好特异性靶点。而同样由张晓坤课题组创新研发的舒林酸衍生物K-80003,能以独特的方式结合tRXRα,诱导tRXR形成四聚体,从而抑制tRXRα与TRAF6的相互作用、NF-κB的活性以及结肠肿瘤的生长。K-80003特异高效的抑瘤作用,有望使其成为低毒副、高疗效的抗癌化合物。
张晓坤教授领导团队长期致力研究核受体的非基因型作用和新型核受体药物的开发。2010年6月该团队在Cancer Cell首次报道了tRXRα在肿瘤细胞的产生及其促进肿瘤发展的分子机制,并筛选出可以特异高效结合tRXRα/RXRα的小分子化合物K-80003。在TNFα存在下,tRXRα与PI3K调节亚基p85α相互作用,激活 AKT,促进肿瘤细胞的生长,而全长的RXRα不能与p85α相互作用。2017年7月该团队在Nature Communications阐释了K-80003可以特异性地诱导截短蛋白tRXRα形成四聚体,使tRXRα失去活性,从而抑制tRXRα诱导的肿瘤增殖。


该论文题为“Oncogenic potential of truncated RXRα during colitis-associated colorectal tumorigenesis by promoting IL-6-STAT3 signaling”。厦门大学药学院博士生叶晓红和吴华为论文的共同第一作者,张晓坤教授为通讯作者。该研究工作获得了国家自然科学基金委、教育部、福建省科技厅、厦门市科技计划项目的经费支持。
论文链接:https://www.nature.com/articles/s41467-019-09375-8
(文:叶晓红,洪昀)

