2017年7月17日,厦大药学院张晓坤教授与苏迎教授课题组的最新研究成果在《自然》(Nature)杂志的子刊《自然通讯》(Nature Communications)上在线发表。该文深入研究并揭示了小分子化合物K-80003发挥肿瘤特异性药效的分子基础,阐述了K-80003如何以一种独特而有效的方式结合于肿瘤靶点tRXRα且抑制其活性,从而抑制癌细胞的增殖。这些发现进一步阐明了K-80003能够成为一种高效低毒的抗癌创新药物的重要原因,为药物的研发提供了强有力的学术背书。此前,K-80003已于2016年12月30日获得美国FDA的临床试验许可批件,正式进入新药上市前的临床人体试验阶段。
肿瘤细胞的快速增殖一直是抗癌治疗的难题所在,而一些抗癌药物同时作用于癌细胞和健康细胞,造成“杀敌一万,自损三千”的治疗结果,也令患者痛苦和无奈。K-80003作为靶向抗癌药物,自研发伊始,就表现出高效低毒的宝贵特性,其根本机理吸引着研究人员的关注。
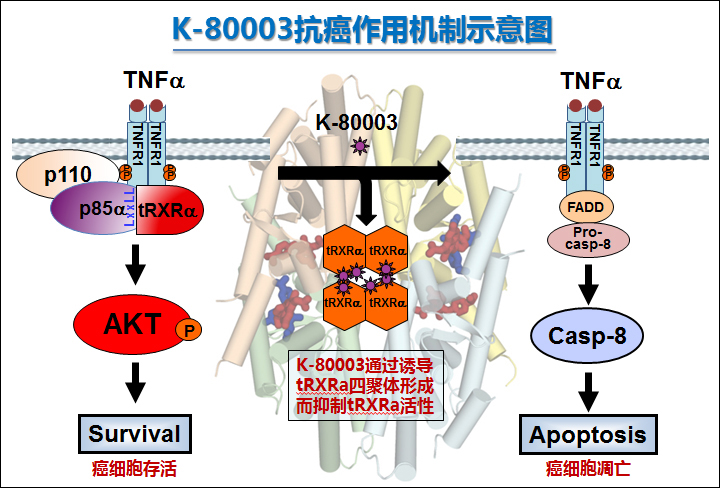
追根溯源,还要从K-80003的作用靶点tRXRα说起。tRXRα是存在于肿瘤细胞和组织中的大量短蛋白片段,与肿瘤的发展密切相关。早在2010年6月,张晓坤课题组就率先在国际顶级期刊《癌细胞》(Cancer Cell)杂志发表了题为“NSAID sulindac and its analog bind RXRa and inhibit RXRa-dependent AKT signaling”的重要论文,首次报道了肿瘤细胞产生tRXRα、促进肿瘤发展的机制。同时该论文也发布了课题组发现的创新小分子化合物K-80003,它可以通过抑制tRXRα的作用,来抑制癌细胞的增殖。K-80003一举成为极具抗癌潜力的化合物,有望产生一种创新抗癌靶点药物。
K-80003的药物研发紧锣密鼓地开展,关于K-80003的具体入微的抗癌机制研究有待层层深入,于是张晓坤教授课题组与苏迎教授课题组共同将目光聚焦在了这一重要的科学问题上。
研究人员通过晶体结构分析等技术方法,结合裸鼠移植瘤实验及MMTV-PyMT转基因小鼠给药实验等一系列实验的多角度论证,最终发现,K-80003是通过特异性地诱导短蛋白tRXRα形成四聚体,使得tRXRα丧失活性,从而中止了癌细胞的增殖。并且,K-80003不会对正常细胞中的全长蛋白RXRα产生作用,避免了误伤健康细胞。“靶向癌细胞的针对性”和“不影响健康细胞的安全性”,充分解释了抗癌药物K-80003的扎实理论依据和创新优点。同时,研究还为今后靶向tRXRα治疗癌症的精准药物开发提供了“构象选择”这一全新而独特的分子生物学视角。
研究团队中,张晓坤教授及其课题组是最早在国际上发现并相继在《科学》《细胞》等杂志上报道了核受体的非基因型作用机制及新型核受体药物开发模式的,K-80003正是依据该模式开发出来的;苏迎教授长期致力于药物的研究与开发,包括药物的发现、设计、优化工作。在这篇论文中,研究人员还创新性地提出了核受体非基因型共调节因子的概念,为深入研究核受体非基因型功能机制提供了方向,相信这将会推动该领域的进一步发展。
该论文的共同第一作者为厦大药学院博士生陈鲤群和美国Sanford Burnham Prebys研究所的Alexander E. Aleshin,张晓坤教授和苏迎教授为共同通讯作者。该研究工作获得了国家自然科学基金委、教育部、福建省科技厅、厦门市科技计划项目的经费支持。论文题为“Modulation of nongenomic activationof PI3K signaling by tetramerization ofN-terminally-cleaved RXRα”(![]() Nature Communs-tRXR-2017.pdf)。
Nature Communs-tRXR-2017.pdf)。