2017年4月20日《美国科学院院报》(PNAS)在线发表了我院吕忠显教授课题组文章: “Nuclear Shp2 directs normal embryo implantation via facilitating the ERα tyrosine phosphorylation by the Src kinase”,揭示了子宫中酪氨酸磷酸酶Shp2调节子宫内膜容受性建立的新机制。
利用动物胚胎植入模型和转基因模式动物,吕忠显研究团队发现Shp2在子宫内膜细胞中特异敲除,可造成胚胎植入完全失败,雌性小鼠不育;机制研究发现,缺失Shp2阻断了子宫内膜基质细胞中的雌激素信号活性。进一步研究发现,Shp2并不像在其他细胞中主要定位于细胞质发挥功能,而是需要进入细胞核中结合雌激素受体,募集并调控Src信号蛋白对雌激素受体(ER)的活化,最终影响雌激素受体靶蛋白的转录,其中包括对子宫接受态建立关键的孕激素受体(PR)的表达调控。
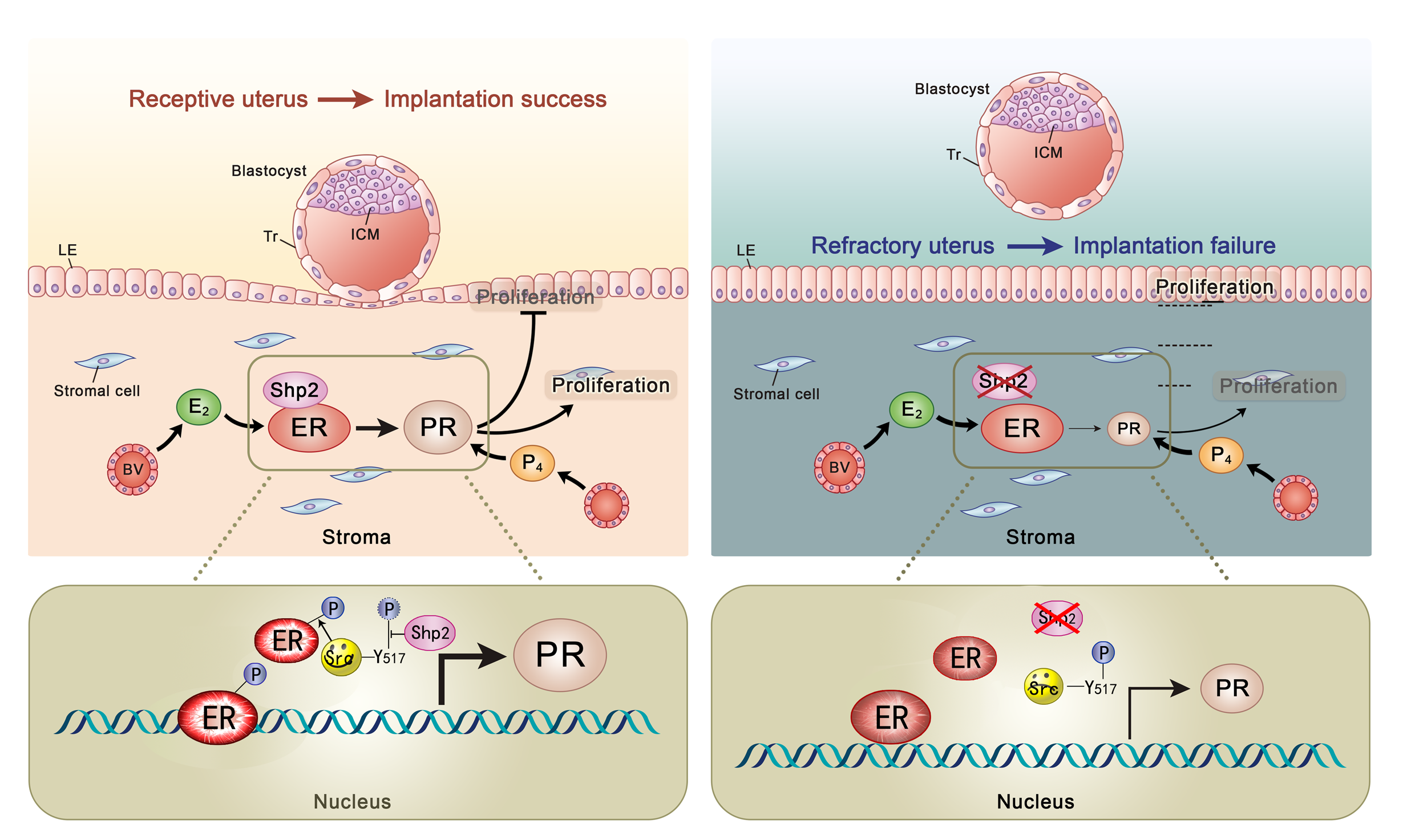
子宫Shp2通过激酶Src参与调控雌激素受体ER转录活性和子宫容受态建立的示意图
受精的胚胎在发育到囊胚阶段后,需要附植到子宫内膜以建立稳固的生理学联系,这个过程称为胚胎植入,是胎儿发育成功的关键事件之一。临床上75%以上的早期妊娠失败或流产都是由异常的胚胎植入造成。胚胎植入的成功需要子宫内膜建立容受性,这主要取决于子宫内膜细胞在雌、孕激素,以及大量局部因子的协同调控下,不同类型内膜细胞发生准确的应答和分化,而涉及其中许多关键环节还有待认识。Shp2能调控多种生长因子和细胞因子信号,该研究证明Shp2介导其它信号促进雌激素受体ER活性发挥的结果,将能促进胚胎植入信号调控网络的理解,对于认识雌、孕激素调控内膜容受态的建立也提供新的思路。
这些工作是与厦大医学院王海滨教授领导的生殖研究团队、中国农业大学王超博士课题组共同完成的。
文章链接 :
http://www.pnas.org/content/early/2017/04/18/1700978114.full.pdf?with-ds=yes

