近日,厦门大学药学院任长亮教授团队成功开发了一类可响应酸性微环境、并在低 pH 条件下被激活的人工离子通道,实现了对多种肿瘤细胞的选择性杀伤。相关研究成果以“Proton-Activated Artificial Channels for pH-Selective Cancer Therapy”为题,在线发表在Angewandte Chemie International Edition杂志(DOI:10.1002/anie.202525440)。

质子激活离子通道是一类能够感知胞外酸化并调控离子跨膜运输的重要生物通道,在缺血、炎症和肿瘤等酸性微环境中发挥关键调控作用。然而,能够在功能和调控方式上有效模拟天然质子激活通道的人工离子通道仍极为有限。另一方面,人工离子通道通过扰乱细胞内离子稳态诱导细胞凋亡,近年来已被视为潜在的抗癌策略。鉴于肿瘤组织普遍存在异常酸化的微环境,发展可被质子激活的人工离子通道,有望实现对癌细胞的精准识别与选择性治疗。
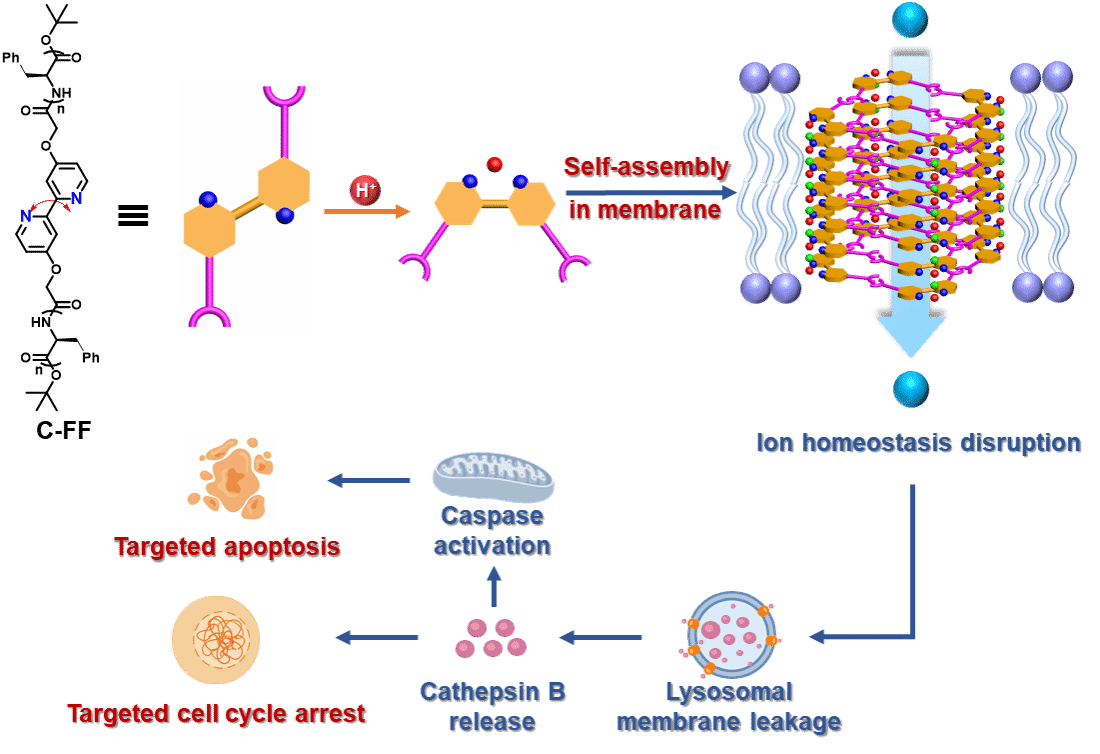
在本研究中,研究团队受到天然质子激活氯离子通道(PACs)构象调控机制的启发,将自组装肽链整合至具有pH响应特性的2,2’-联吡啶骨架中设计并合成了一类新型人工通道分子。该体系在酸性条件下发生质子化,触发通道形成单元由线性构象向折叠构象转变,进而通过氢键和静电作用促进一维自组装,并经疏水侧链堆积形成功能性跨膜通道。功能研究表明,当胞外pH值由7.4降至6.5时,代表性化合物C-FF对人结直肠癌细胞(HCT-116)的抗癌活性增强达10.3倍,IC50低至2.8 μM。更为重要的是,C-FF对癌细胞表现出显著的选择性,其相对于正常肠上皮细胞(HIEC-6)的选择性指数高达 8.5,比临床常用化疗药物阿霉素高出近一个数量级,同时保持相当的细胞毒性水平。机制研究表明,该人工通道通过质子梯度驱动的离子转运破坏自噬稳态,进而诱导细胞凋亡和细胞周期阻滞,从而实现抗肿瘤效应。该研究不仅提出了一种全新的质子激活型人工离子通道分子设计策略,更为构建以内源性病理刺激为触发信号的肿瘤靶向人工通道体系提供了新的思路。
厦门大学药学院2024级博士生罗道鑫为论文第一作者,任长亮教授为论文通讯作者。该项研究得到了国家自然科学基金(22271240),深圳市科技创新局(JCYJ20250604122915021),福建省自然科学基金(2024J010009),翔安创新实验室(2024XAKJ0102001)和厦门大学校长基金(20720250183)的资助。该项研究同时得到了新加坡南洋理工大学Mu Yuguang团队、山东大学李伟峰团队以及厦门大学曾志平团队的大力支持。
论文链接:
https://onlinelibrary.wiley.com/doi/10.1002/anie.202525440
