近日,福建省药物新靶点研究重点实验室、厦门大学药学院李福男团队,联合生命科学学院吴乔、陈航姿、邓贤明团队,成功开发出小分子十二烷基6-羟基-2-萘酸酯(DHN),可通过非经典cGAS-STING通路诱导GSDME依赖性细胞焦亡。该研究不仅拓展了我们对细胞焦亡调控网络的认识,更为肿瘤治疗提供了新靶点和先导化合物。相关研究成果以“cGAS activation converges with intracellular acidification to promote STING aggregation and pyroptosis in tumor models”为题发表于 The Journal of Clinical Investigation期刊。

cGAS-STING信号通路是先天免疫的关键调控因子,并与抗肿瘤免疫应答密切相关。目前,STING激动剂单独治疗或与免疫检查点抑制剂联用正作为新型抗癌疗法接受临床评估。然而,通过调控该通路直接诱导肿瘤细胞死亡的机制仍不清楚。
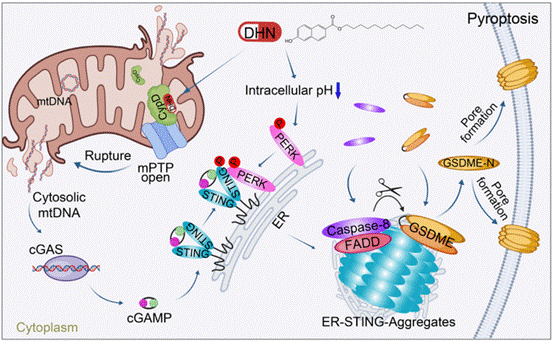
研究团队通过筛选发现能快速诱导肿瘤细胞焦亡的DHN。机制研究表明,DHN通过促进Caspase-8介导的GSDME切割触发细胞焦亡。为进一步验证靶点,团队合成光敏探针DHN-P,结合点击化学技术证实DHN直接靶向线粒体蛋白CypD。进一步研究发现,DHN可诱导线粒体通透性转换孔(mPTP)持续开放,促使线粒体DNA(mtDNA)释放至胞质并与cGAS结合,引发其相分离,进而生成cGAMP激活STING。出乎意料的是,被激活的STING并未沿经典通路从内质网转运至高尔基体,而是在内质网上形成点状聚集体。通过内质网分离纯化实验发现,DHN处理后的内质网显著富集Caspase-8和GSDME。电镜、免疫荧光染色、邻近标记技术及Triton X-100不溶组分分离等实验进一步证实,STING在内质网上聚集,从而为Caspase-8剪切GSDME提供了平台。
在动物模型中,DHN展现出显著的抗肿瘤效果:不仅能抑制裸鼠移植瘤生长,对黑色素瘤皮下移植瘤和肝原位移植瘤也具有显著治疗效果,同时伴随抗肿瘤免疫增强且无明显毒副作用。
本研究阐明:1)DHN通过靶向CypD诱导mPTP持续开放,促使mtDNA释放并激活cGAS;2)DHN引发的胞内酸化激活PERK介导的STING磷酸化,促进STING形成聚集体,为Caspase-8/GSDME提供作用平台。更重要的是,该研究揭示了cGAS-STING通路的非经典功能:当cGAS被激活且胞内pH降低时,可诱导GSDME依赖性细胞焦亡。该研究为肿瘤治疗提供了新靶点和先导化合物。
厦门大学陈航姿教授、吴乔教授、李福男副教授和邓贤明教授为本文的共同通讯作者。生科院博士生肖力、博士后艾元立、博士生米香宇、药学院硕士生梁涵和生科院博士生支祥为本文的共同第一作者。
原文链接:https://www.jci.org/articles/view/188872
