近日,福建省药物新靶点研究重点实验室、厦门大学药学院李福男团队,联合厦门大学附属中山医院洪雪辉、中国医科大学王振宁、宋永喜团队,成功开发出小分子RMY-186可通过靶向CAD-Asp1371突变有效改善化疗疗效。相关研究成果以“Cleavage of CAD by caspase-3 determines the cancer cell fate during chemotherapy”为题发表于 Nature Communications期刊。

肿瘤内异质性引起的代谢异质性介导了肿瘤治疗的大量不良后果,包括化疗耐药性,但其机制在很大程度上仍然未知。
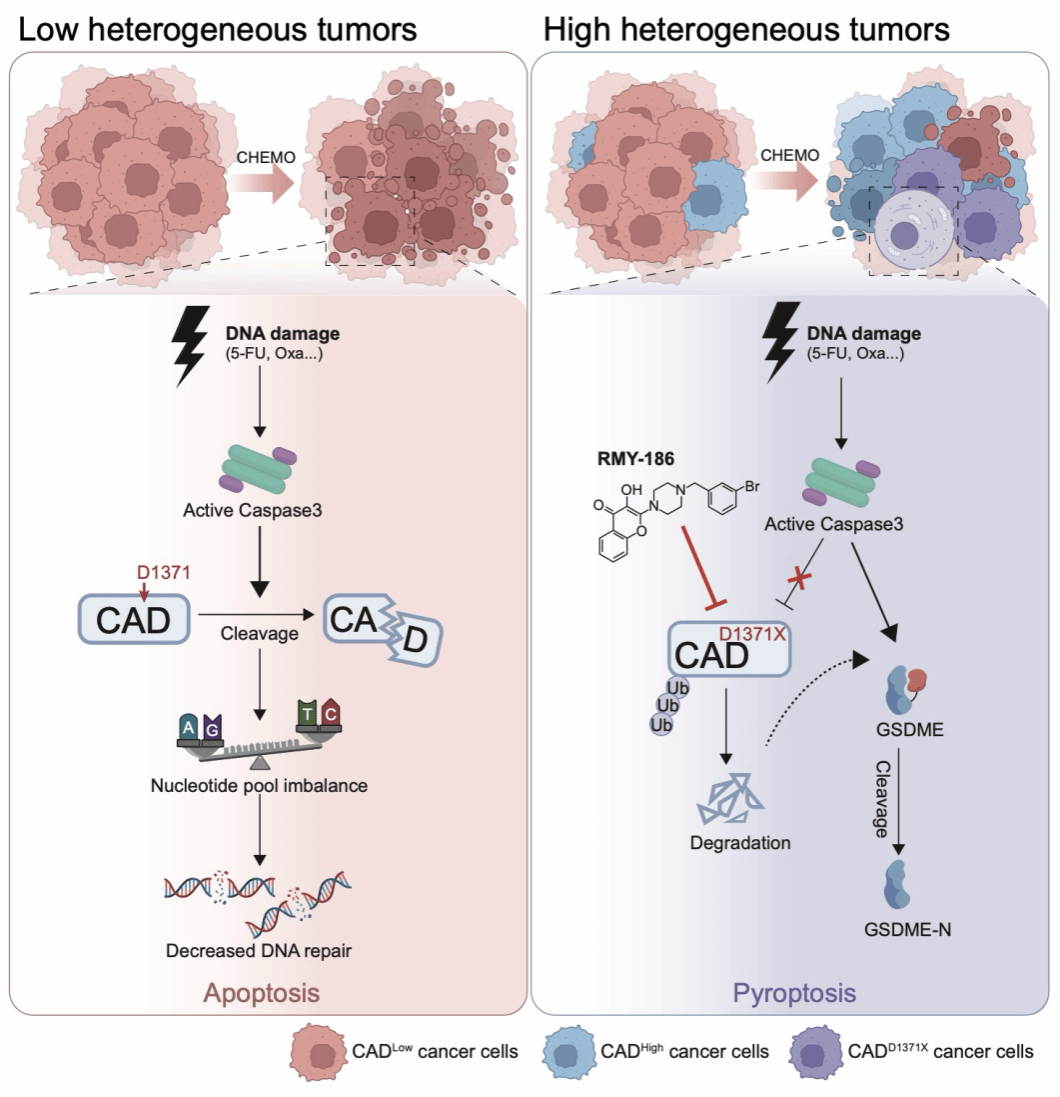
团队研究发现嘧啶核苷酸从头合成途径限速酶酶CAD(二氢羟化酶)在第1371位天冬氨酸(Asp1371)被化疗激活的caspase-3特异性切割导致其表达下降,进而诱导肿瘤细胞凋亡;高表达水平或者具有切割抗性(如Asp 1371突变)的CAD因其不被充分切割降解,能够维持肿瘤细胞内嘧啶核苷酸的正常供给,在化疗抵抗中发挥关键作用。在新辅助化疗失败的肿瘤样本中发现了与CAD-Asp1371相关的突变,使用RMY-186靶向CAD-Asp1371突变可改善化疗疗效。研究工作揭示了在化疗过程中从头合成嘧啶的脆弱性,提示CAD可能成为有前景的治疗靶点和潜在的生物标志物,强调了靶向降解CAD及其Asp1371突变体的小分子抑制剂RMY-186在逆转化疗抵抗方面具有良好的临床应用前景。
研究发现核苷酸合成的上调对胃癌(GC)和和结直肠癌(CRC)细胞的存活也至关重要,这是化疗预后不良的主要原因之一。化疗药物促进胞质氨基甲酰磷酸合成酶II、天冬氨酸转氨甲酰酶和CAD的降解,CAD是一种嘧啶核苷酸合成限速酶,导致细胞凋亡。进一步研究发现,CAD在降解之前需要被caspase-3在其Asp1371残基上裂解。在异种移植和Cldn18-ATK胃癌模型中,过表达CAD或突变Asp1371以阻断caspase-3的裂解可导致化疗耐药。研究进一步通过发现小分子RMY-186提出了克服该耐药机制的药物策略,其可促进野生型和剪切抵抗型CAD突变体的蛋白酶体降解。结构表征显示RMY-186结合CAD中Pro741和Trp743形成的口袋,通过募集E3连接酶BIRC6/UBE3C诱导泛素化。与化疗联用时,RMY-186通过双重机制恢复Asp1371突变肿瘤的敏感性:通过核苷酸耗竭重启细胞凋亡,同时触发GSDME依赖的细胞焦亡——这种效应因该化合物能绕过caspase-3剪切从而实现CAD失活而增强。
这些发现确立了CAD作为胃肠道恶性肿瘤预测性生物标志物和潜在治疗靶点的地位。Asp1371Gly突变的发现为部分化疗耐药病例提供了分子解释,基于肿瘤细胞在基因毒性应激下对嘧啶从头合成的生存依赖性,团队开发的靶向降解剂RMY-186,通过特异性清除耐药性CAD突变体,成功克服化疗抵抗,为靶向干预提供了概念验证。
李福男课题组长期从事创新药物分子的设计、合成及机制研究。
原文链接:https://www.nature.com/articles/s41467-025-60144-2
