近日,厦门大学药学院刘超团队与公共卫生学院刘刚教授团队合作提出了一种可以诱导抗原特异性免疫耐受的反向疫苗策略。相关研究成果以“Epigenetically Reprogrammed Nanovesicles as Inverse Vaccines for Antigen-Speciffc Immune Tolerance in Autoimmune Diseases”为题发表于Nano Letters杂志。该研究受细胞膜作为免疫细胞间信号交互的天然介质这一特性的启发,结合工程化细胞膜囊泡技术,开发了一种基于表观遗传重编程的反向疫苗,用于诱导抗原特异性免疫耐受,实现对自身免疫性疾病的有效治疗。

免疫耐受受损是自身免疫性疾病的主要病理机制,通常导致自身组织破坏或针对无害抗原的异常免疫反应。目前的治疗策略主要集中在症状控制或全身免疫抑制上,虽然能带来部分临床获益,但具有导致严重并发症的风险,包括机会性感染和恶性肿瘤的发生。这凸显了开发能恢复免疫稳态且不损害宿主防御的抗原特异性免疫疗法的迫切需求。
树突状细胞(DC)是外周免疫调节的核心协调者,在决定T细胞命运和功能方面起着关键作用,因此,过继性DC疗法在自身免疫性疾病的治疗中被广泛研究。然而,包括耐受性DC和调节性T细胞(Treg)在内的过继性免疫细胞疗法被报道在复杂的机体环境中可能发生不受控制的表型变化,具有转变为致病效应细胞的可能性,这在很大程度上限制了它们在临床治疗中的应用。因此,建立高效稳定的特异性免疫耐受调控策略是治疗自身免疫性疾病取得突破的关键。
该研究基于刘超团队开发的功能化细胞膜囊泡疫苗平台(Nat Nanotechnol 2022,Angew Chem 2024, et al.),建立了一种基于表观重塑的人工细胞膜囊泡反向疫苗 (mDCNVreg)。经高浓度IFN-γ诱导树突状细胞表观重塑,使其高表达MHC-II分子及免疫共抑制分子,同时低表达共刺激分子。通过囊泡化处理后,mDCNVreg的Cell-Free的结构特性,及纳米级尺寸、由表面分子介导的靶向和调节作用等,赋予其淋巴系统靶向和表型稳定机制,展现持久且强劲的致耐受效力。重要的是,区别于传统疫苗作用方式mDCNVreg 可直接与CD4+ T细胞进行表位特异性交互,诱导CD4+ T细胞耐受分化及克隆无能,从而建立持久的抗原特异性免疫耐受,并在多种自身免疫病模型中实现对疾病进展的有效控制。
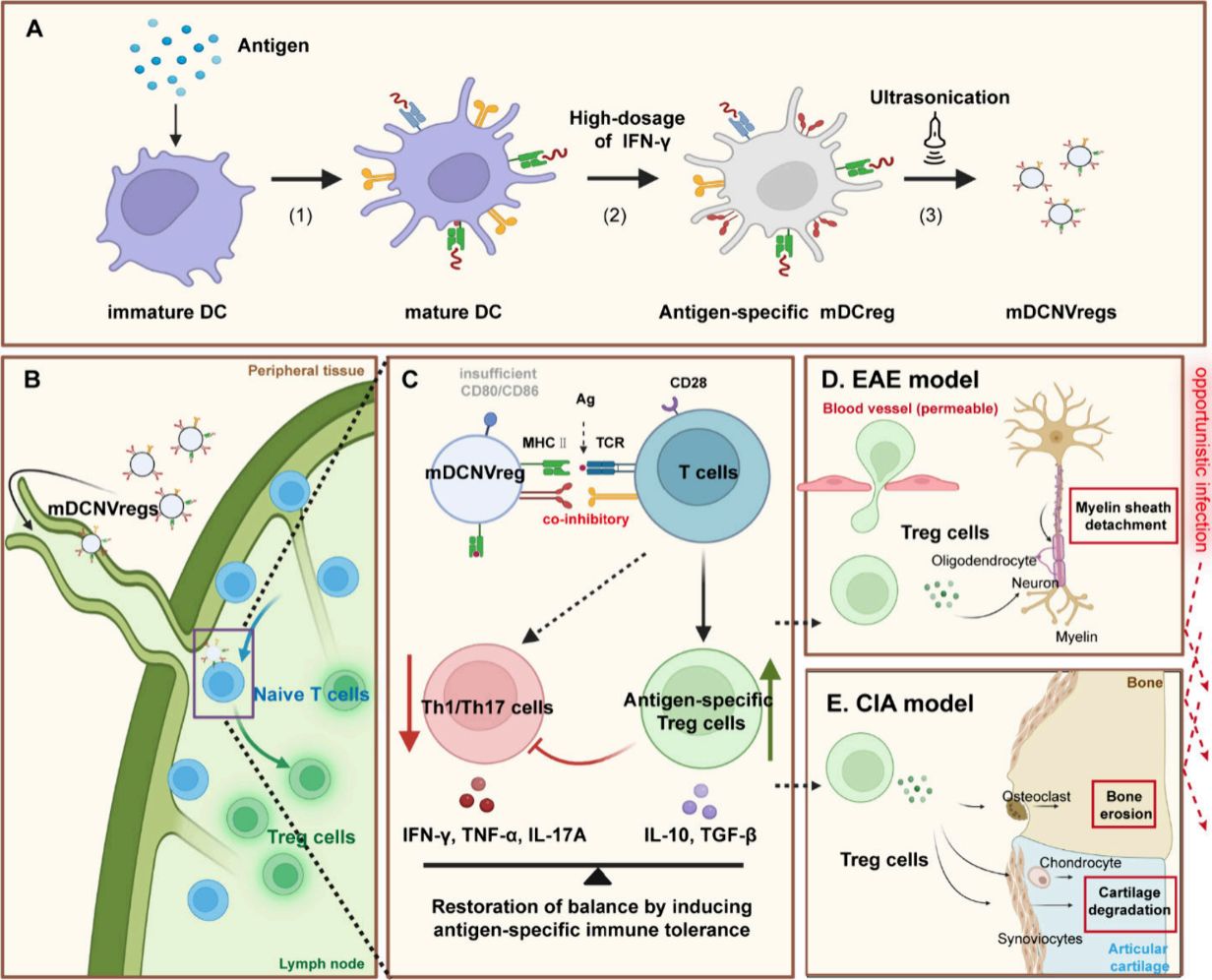
反向疫苗构建新策略及其免疫应答机制示意图
厦门大学药学院刘超副教授、公共卫生学院刘刚教授为该论文共同通讯作者,药学院2022级硕士生席钥等为文章的共同第一作者。该研究工作得到国家自然科学基金、厦门大学“南强青年拔尖人才” 等项目的资助。
论文链接:https://doi.org/10.1021/acs.nanolett.5c00986
