近日,福建省药物新靶点研究重点实验室、厦门大学药学院李福男团队,联合生命科学学院吴乔、陈航姿团队,成功开发出小分子十二烷基-1H-苯并[d]咪唑-5-甲酸酯(DdBIC),能够靶向核受体Nur77,通过切割黑色素瘤细胞中的GSDMC诱导细胞焦亡。该研究不仅拓展了我们对细胞焦亡调控网络的认识,更为肿瘤治疗提供了新靶点和先导化合物。相关研究成果以“Disruption of heme metabolism homeostasis by Nur77 induces pyroptosis through granzyme B-dependent GSDMC cleavage”为题发表于 Signal Transduction and Targeted Therapy期刊。

细胞焦亡在生理与病理过程中起着关键作用。由于黑色素瘤细胞具有抗凋亡性,但表达gasdermin蛋白家族成员,通过诱导gasdermin介导的细胞焦亡来对抗黑色素瘤具有重要前景。然而,目前尚未发现可触发GSDMC介导的细胞焦亡的先导化合物,这限制了该领域的深入研究。本研究首次发现化合物十二烷基-1H-苯并[d]咪唑-5-甲酸酯(DdBIC)能够靶向核受体Nur77,并通过切割黑色素瘤细胞中的GSDMC诱导细胞焦亡。DdBIC结合Nur77后,诱导其形成了一个利于线粒体蛋白HK2结合的微界面,促使其向线粒体转位,进而通过与SDHA互作提高SDH复合物的活性,导致上游代谢物琥珀酰辅酶A的匮乏,损害血红素的从头合成途径。SDH复合体中血红素的匮乏导致电子泄漏并诱导线粒体活性氧(mito-ROS)生成。mito-ROS通过氧化修饰激活蛋白酶OMA1后,引发下游OPA1蛋白被切割成S-OPA1,同时伴随mPTP的开放和线粒体外膜的破裂,使内容物释放到细胞质。胞质中的OPA1结合并促进PERK的二聚化和自磷酸化,从而启动整合应激反应(ISR),进一步提高颗粒酶B的活性,最终剪切GSDMC,GSDMC的N端片段靶向细胞膜打孔,导致细胞发生焦亡。
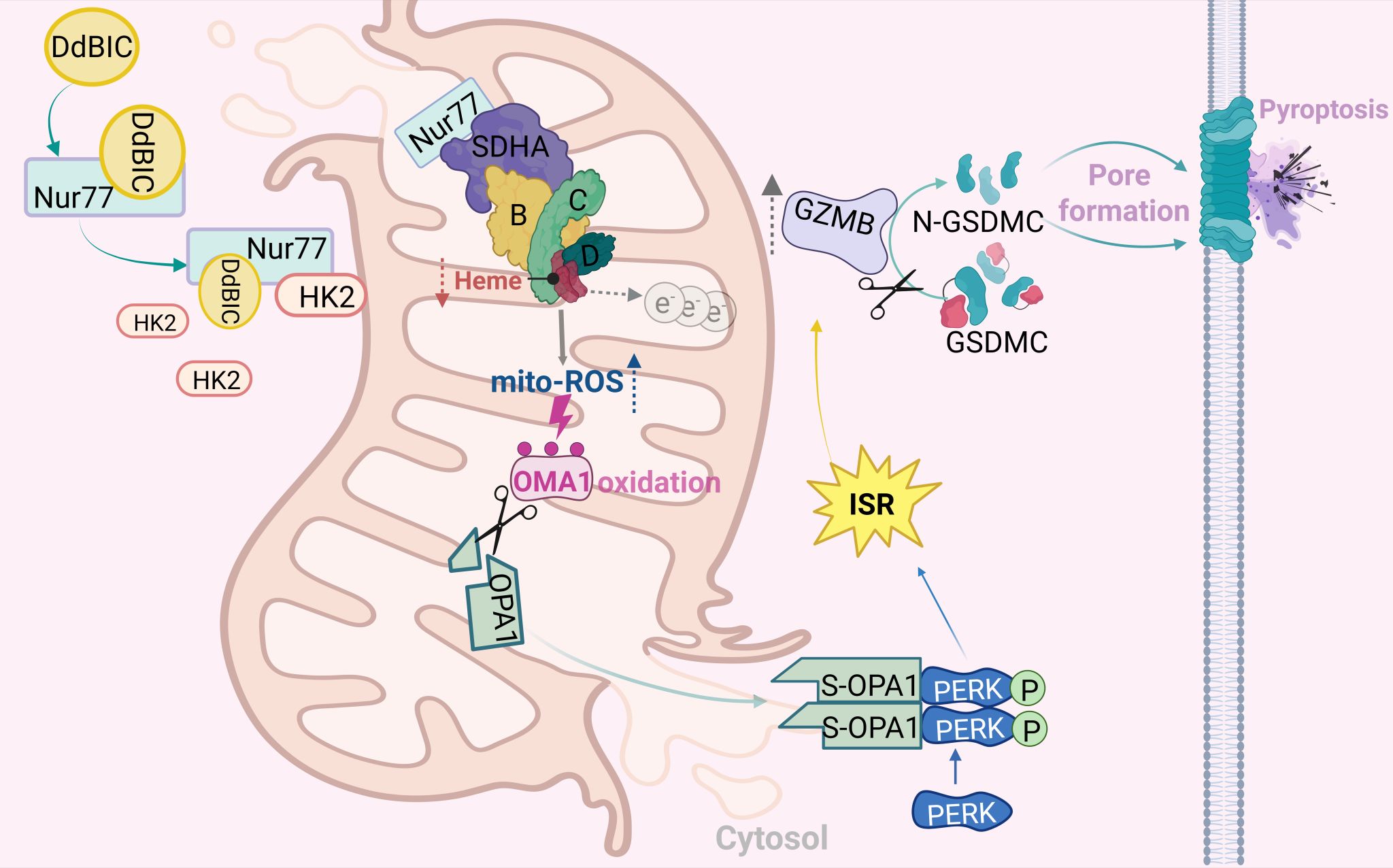
Nur77通过扰动血红素稳态诱导granzyme B-GSDMC介导的细胞焦亡的模式图
本研究不仅揭示了从Nur77介导的血红素代谢紊乱到PERK驱动的整合应激反应(ISR)激活这一完整的信号通路,还首次提出并验证了颗粒酶B切割GSDMC诱导细胞焦亡的新机制,为黑色素瘤的靶向治疗提供了全新策略。
厦门大学吴乔教授、陈航姿教授、陈学勤教授和李福男副教授为本文的共同通讯作者。生科院博士生吴流政、黄雅莹,硕士生胡海婧,附属第一医院博士后洪文斌和药学院博士生颜晗为本文的共同第一作者。
近年来,李福男副教授团队与吴乔教授、洪雪辉教授团队深度合作,围绕肿瘤耐药机制的复杂化与临床治疗策略的局限性等关键医学挑战,聚焦创新药物设计与靶向治疗技术的交叉融合,实现了一系列具有重要影响力的科研成果(《Cell Chemical Biology》(2023)、《Nature Communications》(2025)、《Journal of Clinical Investigation》(2025)及《Signal Transduction and Targeted Therapy》(2025))。授权国家发明专利3项(ZL202211089261.6;ZL202411762228.4;ZL202411762261.7)。
原文链接:https://www.nature.com/articles/s41392-025-02528-w
