低氧是乳腺癌等多种实体肿瘤发生与进展的重要驱动因素之一。癌细胞通过代谢重编程促进自身的生长,以适应低氧微环境。其中,低氧诱导因子(HIFs)作为关键转录因子,调控代谢相关基因的表达,从而影响肿瘤代谢过程,在乳腺癌转移、治疗耐受及不良预后中发挥重要作用。HIFs 已被确立为新型肿瘤标志物和治疗靶点,在治疗多种低氧相关实体瘤方面具有重大潜力。表观遗传调控因子及相关表观遗传修饰广泛参与生物学过程,并与癌症的恶性进展密切相关,是癌症治疗的重要靶标。然而,目前乳腺癌中调控低氧诱导代谢重编程的表观遗传修饰酶及其分子机制尚需进一步阐明。

2025年4月1日,厦门大学药学院刘文教授团队与合作者于Cell Reports发表题为 “Hypoxia-induced PRMT1 Methylates HIF2β to Promote Breast Tumorigenesis via Enhancing Glycolytic Gene Transcription”的研究成果。该研究揭示,在低氧条件下,PRMT1 是 HIF1α下游靶基因之一,而PRMT1可以正反馈增强 HIF1α 介导的糖酵解基因表达。机制上,PRMT1 通过甲基化 HIF2β的第42位精氨酸促进HIF1α/HIF2β异源二聚体的形成,增强其染色质结合能力及转录活性。基因敲降或药物抑制 PRMT1 (使用课题组前期报道的PRMT1特异性抑制剂iPRMT1,Cell Reports, 2023)可显著降低 HIF2β 甲基化、HIF1α/HIF2β 复合物形成、糖酵解基因表达、乳酸生成及乳腺癌细胞的恶性行为。此外,iPRMT1与 HIF1α/P300 相互作用抑制剂 Menadione(MEN)联合使用可协同抑制乳腺癌细胞生长和肿瘤形成。临床样本分析进一步证实PRMT1 及其介导的 HIF2β 甲基化在乳腺癌组织中相较于正常组织显著升高。这是研究团队继 2023 年揭示 PRMT1 甲基化 SRSF1 调控基因可变剪接促乳腺癌后(Cell Reports, 2023),针对PRMT1促癌机制的又一重要进展:PRMT1通过甲基化HIF2β调控糖酵解基因转录促乳腺癌。
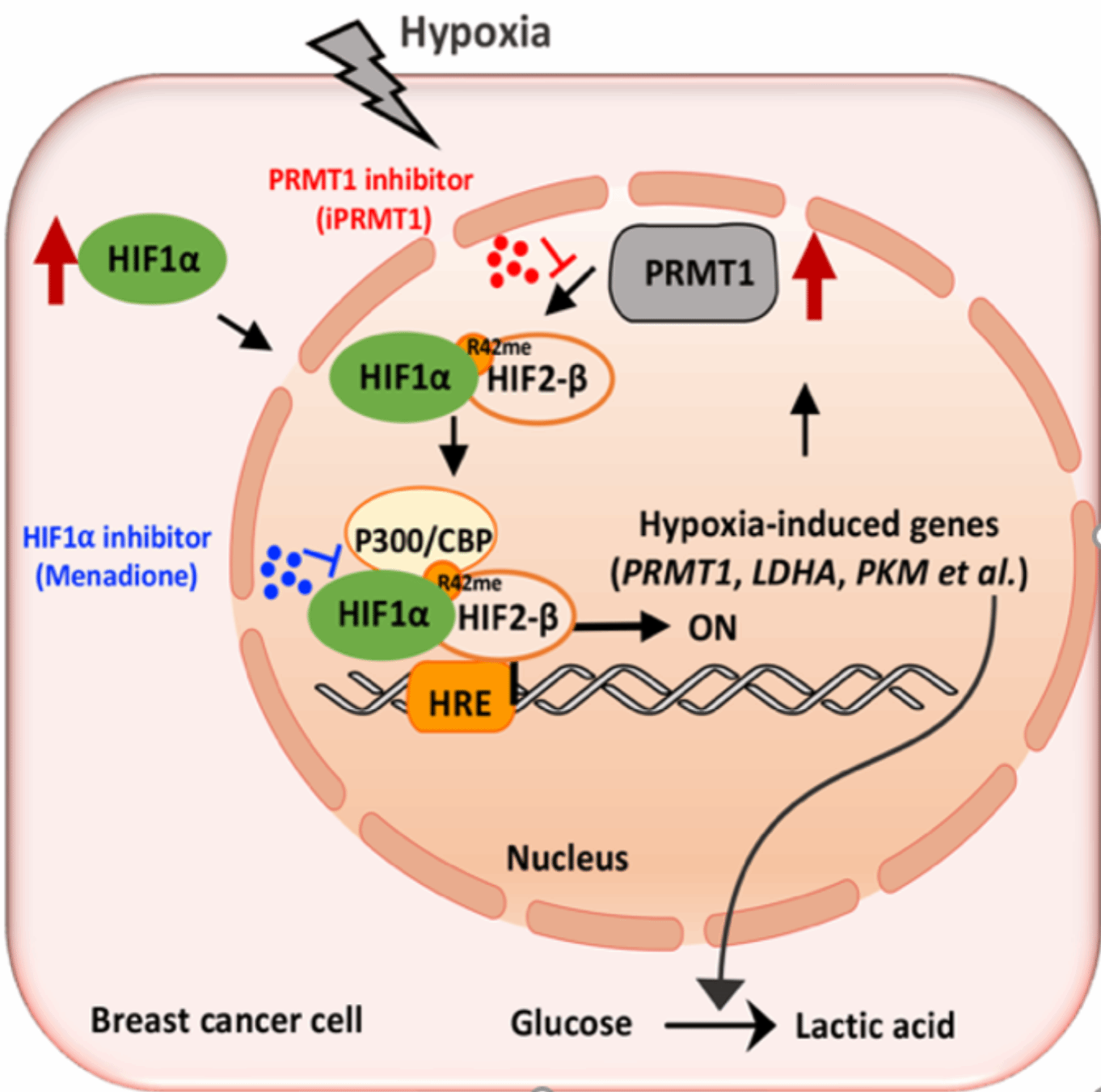
模式图:PRMT1介导的HIF2β甲基化在糖酵解基因表达、代谢重编程及乳腺癌生长中的作用机制和靶向干预研究
厦门大学药学院刘文教授、福建医科大学附属协和医院傅芳萌教授和中南大学湘雅二医院程岩教授为本文的共同通讯作者。厦门大学药学院李文娟副教授为本文的共同第一作者。
论文链接:https://www.cell.com/cell-reports/fulltext/S2211-1247(25)00258-X
