药学院霍帅东教授与德国莱布尼兹材料研究所Andreas Herrmann教授团队合作,在药物活性精准调控的研究方面取得新进展,设计构建了超声控制的力响应纳米开关,可用于药物的精准释放与激活。研究成果以“Mechano-Nanoswitches for Ultrasound-Controlled Drug Activation”为题发表在近期的Advanced Science期刊,同时入选了Rising Star研究专刊系列。
药物的低选择性往往会给癌症治疗带来不必要的毒副作用。如何从根本上消除药物本身带来的不良影响,有效的策略就是在分子层面实现对药物活性的精准调控。此前,霍帅东教授团队与Andreas Herrmann教授团队合作提出了利用超声机械力活化药物的新概念(Nature Chemistry, 2021, 13, 131),随后又实现了超声机械力对蛋白质结构与性质的选择性调控(Angewandte Chemie, 2021, 60, 1493;Angewandte Chemie, 2021, 60, 14707)以及对金属离子基DNA碱基对杂化的动态调控(Chemical Communications, 2021,57, 7438)。然而,传统的聚合物机械力化学(Polymer Mechanochemistry)有着合成步骤繁琐、超声响应时间长等缺点。为此,该团队把纳米结构与机械力化学做了进一步交叉融合,设计了对机械力敏感的纳米结构单元,用于超声控制的药物释放与激活。
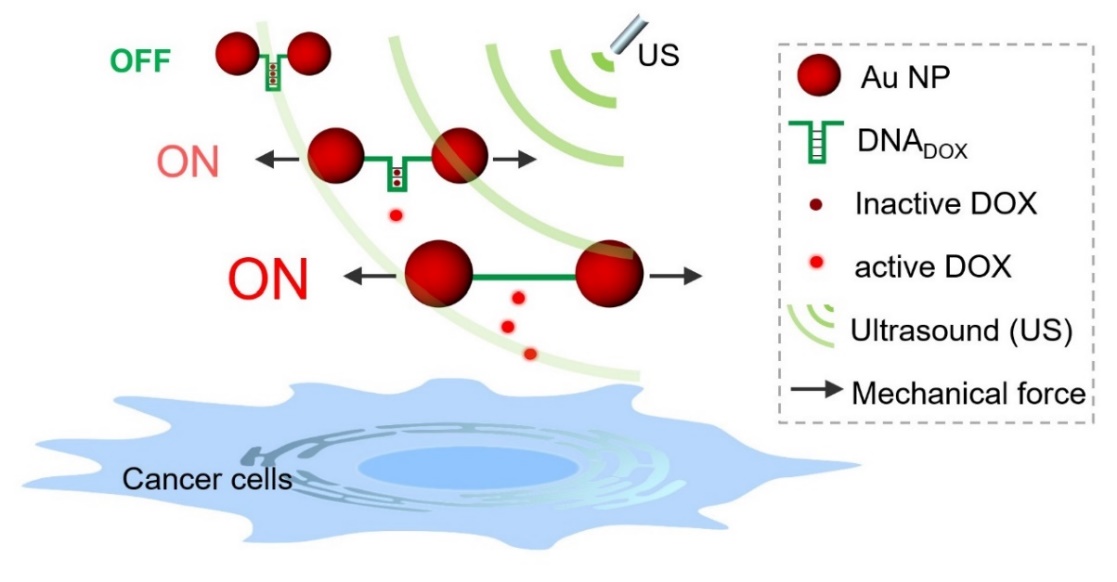
作为概念性研究,研究人员首次构建了一种力响应纳米二聚体单元(nano dimer),该结构可以比拟传统的力响应聚合物单元。简单来说,位于两端的纳米颗粒作为力臂(force transmission arm),而中间的DNA杂化双链则作为力敏团(mechanophore),构成了对机械力敏感的响应开关。重要的是,抗癌药物阿霉素(DOX)可以通过非共价相互作用插入到DNA双链中,使其暂时失去活性(OFF状态)。在超声作用下,纳米开关被逐渐拉伸,DOX与DNA之间的非共价相互作用被破坏,引起药物的释放与激活(ON状态),从而实现对肿瘤细胞的选择性杀伤。值得注意的是,通过调节超声辐照时间,可以实现对药物活性的精准控制。该工作进一步验证了纳米结构在机械力化学应用中的优势,为定制力响应纳米药物激活系统奠定了研究基础(Exploration, 2021, 1, 20210023)。
厦门大学药学院、福建省药物新靶点研究重点实验室为该文第一发表单位,霍帅东教授和Andreas Herrmann教授为共同通讯作者,药学院硕士研究生廖志环参与了该项工作。该工作得到了国家自然科学基金、中央高校基本科研业务费专项资金、厦门大学南强青年拔尖人才项目以及欧盟的多项研究基金的支持。
文章链接:https://onlinelibrary.wiley.com/doi/10.1002/advs.202104696

